antraciclina - Anthracycline
Le antracicline sono una classe di farmaci utilizzati nella chemioterapia del cancro che vengono estratti dal batterio Streptomyces . Questi composti sono usati per trattare molti tipi di cancro, tra cui leucemie , linfomi , cancro al seno , allo stomaco , all'utero , alle ovaie , alla vescica e ai polmoni . La prima antraciclina scoperta è stata la daunorubicina (nome commerciale Daunomicina), che è prodotta naturalmente da Streptomyces peucetius , una specie di actinobatteri . Clinicamente le antracicline più importanti sono la doxorubicina , la daunorubicina , l' epirubicina e l' idarubicina .
Le antracicline sono tra i trattamenti antitumorali più efficaci mai sviluppati e sono efficaci contro più tipi di cancro rispetto a qualsiasi altra classe di agenti chemioterapici. Il loro principale effetto avverso è la cardiotossicità , che ne limita notevolmente l'utilità. È stato anche dimostrato che l'uso di antracicline è significativamente associato a neutropenia febbrile o grave di ciclo 1 . Altri effetti avversi includono il vomito.
I farmaci agiscono principalmente intercalando il DNA e interferendo con il metabolismo del DNA e la produzione di RNA. La citotossicità è principalmente dovuta all'inibizione della topoisomerasi II dopo che l'enzima induce una rottura nel DNA, prevenendo la rilegatura della rottura e portando alla morte cellulare. La struttura di base delle antracicline è quella di una molecola tetraciclica con uno scheletro antrachinonico connesso ad una frazione zuccherina da un legame glicosidico. Quando viene assorbita da una cellula, la struttura a quattro anelli si intercala tra le coppie di basi del DNA mentre lo zucchero si trova all'interno del solco minore e interagisce con le coppie di basi adiacenti.
Storia
La daunorubicina è un farmaco pigmentato rosso scoperto all'inizio degli anni '60. È stato isolato da un ceppo di Streptomyces peucetius da Di Marco e collaboratori, che lavoravano per i laboratori di ricerca Farmitalia in Italia, che lo chiamavano daunomicina. Nello stesso periodo anche Dubost e colleghi in Francia scoprirono il composto e lo chiamarono rubidomicina. Daunorubicin è stato adottato come nome internazionale. Inizialmente si è visto avere attività contro i tumori murini e poi negli studi clinici è risultato essere attivo contro leucemie e linfomi .
La doxorubicina è stata isolata da una variante mutata di S. peucetius (var. caesius ). Si differenzia dalla daunorubicina solo per l'aggiunta di un gruppo ossidrile in posizione carbonio 14. Questa modifica modifica notevolmente l'attività del farmaco rendendolo altamente efficace contro un'ampia gamma di tumori solidi, leucemie e linfomi. È lo standard in base al quale vengono giudicate le nuove antracicline.
Le prime antracicline hanno avuto un tale successo che sono stati prodotti migliaia di analoghi nel tentativo di trovare composti con applicazioni terapeutiche migliorate. Solo l' epirubicina e l' idarubicina sono state adottate per l'uso in tutto il mondo. L'epirubicina ha un'attività simile alla doxorubicina, tuttavia ha effetti collaterali cardiotossici ridotti. L'idarubicina è una variante liposolubile della daunorubicina ed è biodisponibile per via orale.
Diversi gruppi di ricercatori si sono concentrati sulla progettazione di composti che mantenessero il cromoforo aromatico policiclico delle antracicline (favorendo l'intercalazione nel DNA) e sostituendo il residuo zuccherino con semplici catene laterali. Ciò ha portato all'identificazione del mitoxantrone che è classificato come composto antracenedione e viene utilizzato in clinica per la gestione di vari tumori. È stato dimostrato che gli analoghi dei disaccaridi mantengono l'attività antitumorale e vengono ulteriormente studiati rispetto al loro meccanismo d'azione.
Nonostante siano trascorsi 50 anni dalla scoperta delle antracicline e nonostante i recenti progressi nello sviluppo di terapie mirate per i tumori, circa il 32% dei malati di cancro al seno, il 57%-70% dei pazienti anziani con linfoma e il 50-60% dei tumori infantili i pazienti sono trattati con antracicline. Alcuni tumori traggono beneficio dai regimi neoadiuvanti a base di antracicline, e questi includono i tumori al seno triplo negativi che non rispondono bene alle terapie mirate a causa della mancanza di recettori disponibili che possono essere presi di mira. Rispetto ai pazienti con carcinoma mammario non triplo negativo, i pazienti con carcinoma mammario triplo negativo hanno mostrato un tasso di risposta migliore e un tasso di risposta patologica più elevato con l'uso di antracicline, un indicatore utilizzato per prevedere migliori risultati a lungo termine.
Test clinici
Le antracicline rimangono alcuni degli agenti chemioterapici più utilizzati, ma il loro potenziale è limitato dalla loro tossicità dose-limitante. Attualmente sono in corso molti studi alla ricerca di antracicline con una migliore efficacia antitumorale o con effetti collaterali ridotti utilizzando diversi sistemi di somministrazione di farmaci basati sulle nanotecnologie.
Meccanismo di azione
Le antracicline sono state ampiamente studiate per le loro interazioni con i componenti cellulari e l'impatto sui processi cellulari. Ciò include studi su cellule coltivate e su interi sistemi animali. Nella letteratura scientifica è stata documentata una miriade di interazioni farmaco-cellulari che variano in relazione alle proprietà delle cellule bersaglio, alla dose del farmaco e agli intermedi prodotti. Poiché si possono osservare meccanismi d'azione artefatti, i seguenti meccanismi che si verificano a concentrazioni di farmaco clinicamente rilevanti sono i più importanti.
Intercalazione del DNA
Le antracicline sono prontamente assorbite dalle cellule e localizzate nel nucleo . La frazione cromofora delle antracicline ha una funzione intercalante e si inserisce tra la coppia di basi adiacenti del DNA. La funzione intercalante inibisce la sintesi di DNA e RNA in cellule altamente replicanti, bloccando successivamente i processi di trascrizione e replicazione.
Veleno della topoisomerasi II
Questo è di gran lunga il meccanismo più accettato per spiegare l'azione delle antracicline poiché la tossicità mediata dalla topoisomerasi II è evidente a concentrazioni di farmaco clinicamente rilevanti. La topoisomerasi-II è un enzima che crea interruzioni temporanee del DNA a doppio filamento (dsDNA) e le risigilla dopo aver gestito la torsione dei superavvolgimenti del DNA . Le antracicline intercalate nel DNA, formano un complesso ternario stabile antraciclina-DNA-topoisomerasi II, "avvelenando" così l'enzima e impedendo la rilegatura delle rotture del DNA a doppio filamento. Questo danno al DNA mediato dalla topoisomerasi-II successivamente promuove l'arresto della crescita e recluta il meccanismo di riparazione del DNA. Quando il processo di riparazione fallisce, le lesioni avviano la morte cellulare programmata .
Specie reattive dell'ossigeno
La frazione chinonica delle antracicline può subire reazioni redox per generare specie reattive dell'ossigeno (ROS) eccessive in presenza di enzimi ossidoriduttivi come la citocromo P450 reduttasi , la NADH deidrogenasi e la xantina ossidasi . La conversione del chinone in semichinone produce radicali liberi che reagiscono attivamente con l'ossigeno per generare superossidi , radicali idrossilici e perossidi. Inoltre, la disponibilità di ferro cellulare catalizza reazioni redox e genera ulteriormente ROS. I ROS eccessivi che non possono essere disintossicati provocano stress ossidativo, danni al DNA e perossidazione lipidica innescando così l'apoptosi.
Formazione dell'addotto del DNA
Le antracicline possono anche formare addotti con il DNA mediante un singolo legame covalente attraverso un legame amminico dall'amino 3' della daunosamina all'amino esociclico della guanina. La fornitura di formaldeide extracellulare mediante profarmaci che rilasciano formaldeide può promuovere la formazione di addotti di DNA covalente. È stato dimostrato che tali addotti bloccano fattori di trascrizione specifici per GpC e inducono risposte apoptotiche.
Implicazioni cliniche
I risultati di una recente meta-analisi forniscono la prova che i pazienti con cancro al seno con duplicazione del centromero 17 o aberrazioni in TOP2A , il gene che codifica per la topoisomerasi-IIα, beneficiano della chemioterapia adiuvante che incorpora le antracicline. Questo non include i sottogruppi di pazienti che ospitano l'amplificazione di HER2. Le osservazioni di questo studio consentono inoltre di identificare i pazienti in cui le antracicline potrebbero essere omesse in modo sicuro dalle strategie di trattamento.
Effetti collaterali
La somministrazione di antracicline è spesso accompagnata da reazioni avverse ai farmaci che limitano l'uso delle antracicline nelle cliniche. Le due principali tossicità dose limitanti delle antracicline comprendono la mielosoppressione e la cardiotossicità . Fortunatamente, l'introduzione di citochine terapeutiche consente la gestione della mielosoppressione. Quindi, il danno cardiaco rimane il principale svantaggio degli agenti antitumorali a base di antracicline.
La cardiotossicità mediata dalle antracicline è dose-dipendente e cumulativa, con il danno imposto al cuore che si verifica alla prima dose e poi si accumula ad ogni ciclo di antracicline. Sono stati descritti quattro tipi di cardiotossicità associata alle antracicline.
| Tipi di cardiotossicità | Tempo alla presentazione | Sintomi |
|---|---|---|
| acuto | Durante e subito dopo la somministrazione del farmaco | Vasodilatazione, ipotensione, disturbi transitori del ritmo cardiaco |
| subcronico | 1-3 giorni dopo la somministrazione del farmaco | Pericardite-miocardite |
| Cronico precoce | Meno di 1 anno dopo aver completato il trattamento con antracicline | Cardiomiopatia dilatativa, cardiomiopatia restrittiva (non comune), disfunzione contrattile ventricolare sinistra, insufficienza cardiaca congestizia |
| Cronico ritardato/tardivo | Più di 1 anno dopo aver completato il trattamento con antracicline | Cardiomiopatia restrittiva, cardiomiopatia dilatativa, insufficienza cardiaca congestizia |
In clinica, viene fissata una dose cumulativa massima raccomandata per le antracicline per prevenire lo sviluppo di insufficienza cardiaca congestizia . Ad esempio, l'incidenza di insufficienza cardiaca congestizia è rispettivamente del 4,7%, 26% e 48% quando i pazienti hanno ricevuto doxorubicina a 400 mg/m 2 , 550 mg/m 2 e 700 mg/m 2 . Pertanto, l'esposizione cumulativa alla doxorubicina nel corso della vita è limitata a 400-450 mg/m 2 al fine di ridurre l'incidenza dell'insufficienza cardiaca congestizia a meno del 5%, sebbene esistano variazioni in termini di tolleranza alla doxorubicina tra gli individui. I fattori di rischio che influenzano l'entità del danno cardiaco causato dalle antracicline includono variabilità genetica, età (fasce di età bassa o alta), precedenti trattamenti con farmaci cardiotossici e storia di malattie cardiache. I bambini sono particolarmente a rischio a causa dell'attività delle antracicline che può compromettere lo sviluppo del cuore immaturo.
Il danno cardiaco che si verifica in risposta alle dosi iniziali di antraciclina può essere rilevato da un aumento del livello di troponina subito dopo la somministrazione. La biopsia consente anche la diagnosi precoce del danno cardiaco valutando i cambiamenti dell'ultrastruttura cardiaca. La ricezione di dosi cumulative di antraciclina provoca disfunzione del ventricolo sinistro e con il dosaggio continuato raggiunge una certa soglia che può essere rilevata clinicamente con tecniche non invasive come l' ecocardiografia 2D e l'imaging della velocità di deformazione . I progressi nello sviluppo di tecniche di imaging e biomarcatori più sensibili consentono la diagnosi precoce della cardiotossicità e consentono un intervento cardioprotettivo per prevenire la cardiotossicità mediata dalle antracicline.
La suscettibilità predominante del cuore alle antracicline è dovuta in parte a una localizzazione mitocondriale preferenziale delle antracicline. Ciò è attribuito all'interazione ad alta affinità tra antracicline e cardiolipina, un fosfolipide presente nella membrana mitocondriale del cuore, poiché il tessuto cardiaco contiene un numero relativamente elevato di mitocondri per cellula. Il tessuto cardiaco ha anche una difesa alterata contro lo stress ossidativo, mostrando un basso livello di enzimi antiossidanti come catalasi e superossido dismutasi per disintossicare i ROS mediati dalle antracicline.
I meccanismi che spiegano il danno cardiaco indotto dalle antracicline sono complessi e interconnessi. È stato inizialmente riconosciuto essere correlato allo stress ossidativo indotto dalle antracicline. È emersa una spiegazione più recente, in cui la cardiotossicità mediata dalle antracicline è dovuta all'avvelenamento da antraciclina-topoisomerasi IIb, che porta a stress ossidativo a valle.
Al fine di ridurre l'impatto del danno cardiaco in risposta alle antracicline, sono state esplorate alcune strategie cardioprotettive. Sono state sviluppate formulazioni liposomiali di antracicline (discusse di seguito) e utilizzate per ridurre il danno cardiaco. Altri nuovi analoghi dell'antraciclina come l'epirubicina e l'idarubicina forniscono anche opzioni per ridurre gli eventi cardiaci avversi; questi analoghi non sono riusciti a mostrare un'attività antitumorale superiore ai composti progenitori. Un metodo alternativo di somministrazione del farmaco che prevede l' infusione continua per 72 ore rispetto alla somministrazione in bolo fornisce una certa protezione e può essere utilizzato quando si prevedono alte dosi cumulative.
Quando le antracicline vengono somministrate per via endovenosa, può provocare uno stravaso accidentale nei siti di iniezione. Si stima che l' incidenza dello stravaso sia compresa tra lo 0,1% e il 6%. Lo stravaso provoca gravi complicazioni ai tessuti circostanti con sintomi di necrosi tissutale e ulcerazioni cutanee. Il dexrazoxano viene utilizzato principalmente per il trattamento delle antracicline post-stravaso agendo come inibitore della topoisomerasi II e come agente chelante per ridurre lo stress ossidativo causato dalle antracicline. Dexrazoxano è stato utilizzato anche con successo come un composto cardioprotettivo in combinazione con doxorubicina in pazienti con carcinoma metastatico della mammella che sono stati trattati con più di 300 mg / m 2 doxorubicina, così come nei pazienti che sono previsti per avere un effetto benefico da alta cumulativa dosi di doxorubicina.
Non ci sono prove di alta qualità per confermare l'efficacia dei trattamenti cardioprotettivi. Gli studi sulla natura cardioprotettiva del dexrazoxano forniscono prove che può prevenire il danno cardiaco senza interferire con gli effetti antitumorali del trattamento con antracicline. I pazienti trattati con dexrazoxano con il loro trattamento con antracicline hanno avuto il rischio di insufficienza cardiaca ridotto rispetto a quelli trattati con antracicline senza dexrazoxano. Tuttavia, non c'era alcun effetto sulla sopravvivenza.
La doxorubicina radiomarcata è stata utilizzata come agente di imaging delle lesioni del cancro al seno in uno studio pilota. Questo radiochimico, 99m Tc-doxorubicina, è localizzato nelle lesioni del tumore mammario in pazienti di sesso femminile ed è un potenziale radiofarmaco per l'imaging dei tumori al seno.
In alcuni casi, le antracicline possono essere inefficaci a causa dello sviluppo della resistenza ai farmaci . Può essere una resistenza primaria (risposta insensibile alla terapia iniziale) o una resistenza acquisita (presente dopo aver dimostrato una risposta completa o parziale al trattamento). La resistenza alle antracicline coinvolge molti fattori, ma è spesso correlata alla sovraespressione della proteina di efflusso del farmaco transmembrana P-glicoproteina (P-gp) o della proteina multiresistenza 1 ( MRP1 ), che rimuove le antracicline dalle cellule tumorali. Un grande sforzo di ricerca è stato concentrato nella progettazione di inibitori contro MRP1 per risensibilizzare le cellule resistenti alle antracicline, ma molti di questi farmaci hanno fallito durante gli studi clinici.
Formulazioni cliniche a base liposomiale
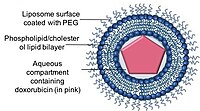
I liposomi sono di forma sferica, vescicole fosfolipidiche che si possono formare con uno o più doppi strati lipidici con fosfolipidi o colesteroli. La capacità dei liposomi di incapsulare composti farmaceutici sia idrofobici che idrofili ha consentito ai liposomi di essere un efficiente sistema di somministrazione di farmaci (DDS) per fornire una gamma di farmaci in questi nano-vettori.
Le formulazioni liposomiali di antracicline sono state sviluppate per mantenere o addirittura aumentare l'efficacia terapeutica delle antracicline riducendone al contempo le tossicità limitanti per i tessuti sani, in particolare la cardiotossicità. Attualmente, nelle cliniche sono disponibili due formulazioni liposomiali di doxorubicina.
Doxil/Caelyx è il primo DDS liposomiale approvato dalla FDA ed è stato inizialmente utilizzato per il trattamento del sarcoma di Kaposi correlato all'AIDS nel 1995 e ora viene utilizzato per il trattamento del cancro ovarico ricorrente , del cancro al seno metastatico con aumentato rischio cardiaco e del mieloma multiplo. La doxorubicina è incapsulata in un nano-vettore noto come liposomi Stealth o stabilizzati stericamente, costituito da liposomi unilamellari rivestiti con polimero idrofilo glicole polietilenico (PEG) che è legato in modo covalente ai fosfolipidi liposomiali. Il rivestimento in PEG funge da barriera contro l' opsonizzazione , la rapida eliminazione mentre il farmaco viene trattenuto stabilmente all'interno dei nano-vettori tramite un gradiente chimico di solfato di ammonio. Uno dei principali vantaggi dell'utilizzo dei nano-vettori come sistema di somministrazione dei farmaci è la capacità dei nano-vettori di utilizzare la permeabilità vascolare dei tumori e il loro drenaggio linfatico alterato tramite l'effetto EPR.
La concentrazione plasmatica massima di doxorubicina libera dopo la somministrazione di Doxil è sostanzialmente inferiore rispetto alla doxorubicina convenzionale, fornendo una spiegazione per il suo basso profilo di cardiotossicità. Tuttavia, Doxil può causare eritrodisestesia palmo -plantare (DPI, sindrome della mano e del piede) a causa del suo accumulo nella pelle. Doxil ha una minore dose massima tollerabile (MTD) a 50 mg / m 2 ogni 4 settimane rispetto alla doxorubicina libera a 60 mg / m 2 ogni 3 settimane. Nonostante ciò, la dose cumulativa massima per Doxil è ancora più elevata rispetto alla doxorubicina a causa delle sue caratteristiche cardioprotettive.
Myocet è un altro complesso di doxorubicina citrato incapsulato in liposomi non pegilati approvato per l'uso in combinazione con ciclofosfamide in pazienti con carcinoma mammario metastatico come trattamento di prima linea in Europa e Canada. La doxorubicina viene caricata nei liposomi appena prima della somministrazione ai pazienti con una dose singola massima di 75 mg/m 2 ogni 3 settimane. Myocet ha un'efficacia simile alla doxorubicina convenzionale, riducendo significativamente la tossicità cardiaca.
| Doxil | Myocet | Riferimenti | |
|---|---|---|---|
| Composizione dei liposomi | PEG-fosfolipide
fosfolipide Colesterolo |
fosfolipide
Colesterolo |
|
| Taglia | 80 nm – 100 nm | 150 nm - 250 nm | |
| Metodo di caricamento del farmaco | Gradiente di sale di ammonio | Gradiente di acido citrico | |
| farmacocinetica | Dose: una singola dose a 10 mg / m 2 - 20 mg / m 2 di concentrazione plasmatica di picco: 7,4 uM - 15.3 uM
Emivita di eliminazione: 50,2 h – 54,5 h |
Dosi: singola dose a 60 mg / m 2
Concentrazione plasmatica di picco: 16 μM Emivita di eliminazione: 16,4 h |
|
| Indicazione clinica | Sarcoma di Kaposi correlato all'AIDS, carcinoma ovarico ricorrente e carcinoma mammario metastatico | Cancro al seno metastatico |
Interazioni farmacologiche avverse
Le interazioni farmacologiche con le antracicline possono essere complesse e potrebbero essere dovute all'effetto, agli effetti collaterali o al metabolismo dell'antraciclina. I farmaci che inibiscono il citocromo P450 o altre ossidasi possono ridurre la clearance delle antracicline, prolungando la loro emivita circolante che può aumentare la cardiotossicità e altri effetti collaterali. Poiché agiscono come antibiotici, le antracicline possono ridurre l'efficacia dei trattamenti con colture vive come la terapia con Bacillus Calmette-Guerin per il cancro alla vescica. Poiché agiscono come mielosoppressori, le antracicline possono ridurre l'efficacia dei vaccini inibendo il sistema immunitario.
Diverse interazioni sono di particolare importanza clinica. Sebbene il dexrazoxano possa essere utilizzato per mitigare la cardiotossicità o il danno da stravaso delle antracicline, può anche ridurne l'efficacia e la raccomandazione è di non iniziare il trattamento con dexrazoxano dopo il trattamento iniziale con antracicline. Trastuzumab (un anticorpo HER2 usato per trattare il cancro al seno) può aumentare la cardiotossicità delle antracicline sebbene l'interazione possa essere ridotta al minimo implementando un intervallo di tempo tra l'antraciclina e la somministrazione di trastuzumab . I tassani (eccetto docetaxel) possono diminuire il metabolismo delle antracicline, aumentando le concentrazioni sieriche di antracicline. La raccomandazione è di trattare prima con antracicline se è richiesto un trattamento combinato con taxani.
Guarda anche
Riferimenti
![]() Questo articolo è stato adattato dalla seguente fonte con una licenza CC BY 4.0 ( 2019 ) ( rapporti dei revisori ):
Alison Cheong; Sean McGrath; Suzanne Cutts (6 dicembre 2018). "Antracicline". WikiJournal of Medicine . 5 (1): 1. doi : 10.15347/WJM/2018.001 . ISSN 2002-4436 . Wikidata Q60638523 .
Questo articolo è stato adattato dalla seguente fonte con una licenza CC BY 4.0 ( 2019 ) ( rapporti dei revisori ):
Alison Cheong; Sean McGrath; Suzanne Cutts (6 dicembre 2018). "Antracicline". WikiJournal of Medicine . 5 (1): 1. doi : 10.15347/WJM/2018.001 . ISSN 2002-4436 . Wikidata Q60638523 .
Appunti
link esterno
-
 Mezzi relativi alle antracicline su Wikimedia Commons
Mezzi relativi alle antracicline su Wikimedia Commons