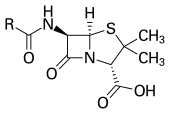
Antibiotico -Antibiotic
| Antibiotico | |
|---|---|
| Classe di droga | |
 Testare la suscettibilità di Staphylococcus aureus agli antibiotici con il metodo di diffusione del disco di Kirby-Bauer : gli antibiotici si diffondono dai dischi contenenti antibiotici e inibiscono la crescita di S. aureus , determinando una zona di inibizione.
| |
| In Wikidata |
Un antibiotico è un tipo di sostanza antimicrobica attiva contro i batteri . È il tipo più importante di agente antibatterico per combattere le infezioni batteriche e i farmaci antibiotici sono ampiamente utilizzati nel trattamento e nella prevenzione di tali infezioni. Possono uccidere o inibire la crescita dei batteri. Un numero limitato di antibiotici possiede anche attività antiprotozoaria . Gli antibiotici non sono efficaci contro virus come il comune raffreddore o l'influenza; i farmaci che inibiscono i virus sono chiamati farmaci antivirali o antivirali piuttosto che antibiotici.
A volte, il termine antibiotico - letteralmente "vita contraria", dalle radici greche ἀντι anti , "contro" e βίος bios , "vita" - è ampiamente usato per riferirsi a qualsiasi sostanza usata contro i microbi , ma nel solito uso medico, antibiotici (come la penicillina ) sono quelli prodotti naturalmente (da un microrganismo combattendo un altro), mentre gli antibatterici non antibiotici (come i sulfamidici e gli antisettici ) sono completamente sintetici . Tuttavia, entrambe le classi hanno lo stesso obiettivo di uccidere o prevenire la crescita di microrganismi ed entrambe sono incluse nella chemioterapia antimicrobica . Gli "antibatterici" includono farmaci antisettici , saponi antibatterici e disinfettanti chimici , mentre gli antibiotici sono un'importante classe di antibatterici usati più specificamente in medicina e talvolta nell'alimentazione del bestiame .
Gli antibiotici sono stati usati fin dall'antichità. Molte civiltà hanno utilizzato l'applicazione topica del pane ammuffito, con molti riferimenti ai suoi effetti benefici derivanti dall'antico Egitto, dalla Nubia, dalla Cina , dalla Serbia , dalla Grecia e da Roma. La prima persona a documentare direttamente l'uso delle muffe per curare le infezioni fu John Parkinson (1567–1650). Gli antibiotici hanno rivoluzionato la medicina nel 20° secolo. Alexander Fleming (1881–1955) scoprì la penicillina moderna nel 1928, il cui uso diffuso si rivelò significativamente vantaggioso durante la guerra. Tuttavia, l'efficacia e il facile accesso agli antibiotici hanno anche portato al loro uso eccessivo e alcuni batteri hanno sviluppato resistenza nei loro confronti. L' Organizzazione Mondiale della Sanità ha classificato la resistenza antimicrobica come una "grave minaccia [che] non è più una previsione per il futuro, sta accadendo proprio ora in ogni regione del mondo e ha il potenziale per colpire chiunque, di qualsiasi età, in qualsiasi paese". I decessi globali attribuibili alla resistenza antimicrobica sono stati 1,27 milioni nel 2019.
Etimologia
Il termine "antibiosi", che significa "contro la vita", è stato introdotto dal batteriologo francese Jean Paul Vuillemin come nome descrittivo del fenomeno esibito da questi primi farmaci antibatterici. L'antibiosi fu descritta per la prima volta nel 1877 nei batteri, quando Louis Pasteur e Robert Koch osservarono che un bacillo nell'aria poteva inibire la crescita del Bacillus anthracis . Questi farmaci furono successivamente ribattezzati antibiotici da Selman Waksman , un microbiologo americano, nel 1947.
Il termine antibiotico fu usato per la prima volta nel 1942 da Selman Waksman e dai suoi collaboratori in articoli di giornale per descrivere qualsiasi sostanza prodotta da un microrganismo che fosse antagonista alla crescita di altri microrganismi in alta diluizione. Questa definizione escludeva le sostanze che uccidono i batteri ma che non sono prodotte da microrganismi (come i succhi gastrici e il perossido di idrogeno ). Escludeva anche composti antibatterici sintetici come i sulfamidici . Nell'uso corrente, il termine "antibiotico" viene applicato a qualsiasi farmaco che uccida i batteri o ne inibisca la crescita, indipendentemente dal fatto che quel farmaco sia prodotto o meno da un microrganismo.
Il termine "antibiotico" deriva da anti + βιωτικός ( biōtikos ), "idoneo alla vita, vivace", che deriva da βίωσις ( biōsis ), "modo di vivere", e quello da βίος ( bios ), "vita". Il termine "antibatterico" deriva dal greco ἀντί ( anti ), "contro" + βακτήριον ( baktērion ), diminutivo di βακτηρία ( baktēria ), "bastone, canna", perché i primi batteri ad essere scoperti furono i bastoncelli.
Utilizzo
Usi medici
Gli antibiotici sono usati per trattare o prevenire le infezioni batteriche e talvolta le infezioni da protozoi . ( Il metronidazolo è efficace contro numerose malattie parassitarie ). Quando si sospetta che un'infezione sia responsabile di una malattia ma non è stato identificato l'agente patogeno responsabile, viene adottata una terapia empirica . Ciò comporta la somministrazione di un antibiotico ad ampio spettro basato sui segni e sintomi presentati e viene avviato in attesa dei risultati di laboratorio che possono richiedere diversi giorni.
Quando il microrganismo patogeno responsabile è già noto o è stato identificato, può essere iniziata la terapia definitiva . Questo di solito comporterà l'uso di un antibiotico a spettro ristretto. Anche la scelta dell'antibiotico somministrato dipenderà dal suo costo. L'identificazione è di fondamentale importanza in quanto può ridurre il costo e la tossicità della terapia antibiotica e anche ridurre la possibilità di comparsa di resistenza antimicrobica. Per evitare un intervento chirurgico, possono essere somministrati antibiotici per l' appendicite acuta non complicata .
Gli antibiotici possono essere somministrati come misura preventiva e questo è solitamente limitato alle popolazioni a rischio come quelle con un sistema immunitario indebolito (in particolare nei casi di HIV per prevenire la polmonite ), quelle che assumono farmaci immunosoppressori , i malati di cancro e quelli sottoposti a intervento chirurgico . Il loro uso nelle procedure chirurgiche serve a prevenire l'infezione delle incisioni . Hanno un ruolo importante nella profilassi antibiotica dentale dove il loro uso può prevenire la batteriemia e la conseguente endocardite infettiva . Gli antibiotici vengono utilizzati anche per prevenire l'infezione nei casi di neutropenia , in particolare correlati al cancro.
L'uso di antibiotici per la prevenzione secondaria della malattia coronarica non è supportato dalle attuali prove scientifiche e può effettivamente aumentare la mortalità cardiovascolare, la mortalità per tutte le cause e l'insorgenza di ictus.
Vie di amministrazione
Esistono diverse vie di somministrazione per il trattamento antibiotico. Gli antibiotici sono generalmente assunti per via orale . Nei casi più gravi, in particolare nelle infezioni sistemiche profonde , gli antibiotici possono essere somministrati per via endovenosa o per iniezione. Laddove il sito dell'infezione è facilmente accessibile, gli antibiotici possono essere somministrati localmente sotto forma di colliri sulla congiuntiva per la congiuntivite o gocce per le orecchie per le infezioni dell'orecchio e nei casi acuti di orecchio del nuotatore . L'uso topico è anche una delle opzioni di trattamento per alcune condizioni della pelle tra cui l'acne e la cellulite . I vantaggi dell'applicazione topica includono il raggiungimento di una concentrazione elevata e prolungata di antibiotico nel sito dell'infezione; riducendo il potenziale di assorbimento e tossicità sistemici e i volumi totali di antibiotici richiesti, riducendo così anche il rischio di uso improprio degli antibiotici. È stato segnalato che gli antibiotici topici applicati su alcuni tipi di ferite chirurgiche riducono il rischio di infezioni del sito chirurgico. Tuttavia, ci sono alcune cause generali di preoccupazione per la somministrazione topica di antibiotici. Può verificarsi un certo assorbimento sistemico dell'antibiotico; la quantità di antibiotico applicata è difficile da dosare con precisione ed esiste anche la possibilità che si verifichino reazioni di ipersensibilità locale o dermatite da contatto . Si raccomanda di somministrare gli antibiotici il prima possibile, soprattutto nelle infezioni pericolose per la vita. Molti reparti di emergenza immagazzinano antibiotici per questo scopo.
Consumo globale
Il consumo di antibiotici varia ampiamente tra i paesi. Il rapporto dell'OMS sulla sorveglianza del consumo di antibiotici pubblicato nel 2018 ha analizzato i dati del 2015 provenienti da 65 paesi. Come misurato in dosi giornaliere definite per 1.000 abitanti al giorno. La Mongolia ha avuto il consumo più alto con un tasso di 64,4. Il Burundi ha avuto il minimo con 4,4. Amoxicillina e amoxicillina/acido clavulanico sono stati i più frequentemente consumati.
Effetti collaterali
Gli antibiotici vengono sottoposti a screening per eventuali effetti negativi prima della loro approvazione per l'uso clinico e sono generalmente considerati sicuri e ben tollerati. Tuttavia, alcuni antibiotici sono stati associati a un'ampia estensione di effetti collaterali negativi che vanno da lievi a molto gravi a seconda del tipo di antibiotico utilizzato, dei microbi presi di mira e del singolo paziente. Gli effetti collaterali possono riflettere le proprietà farmacologiche o tossicologiche dell'antibiotico o possono comportare ipersensibilità o reazioni allergiche . Gli effetti avversi vanno da febbre e nausea a reazioni allergiche maggiori, comprese fotodermatite e anafilassi .
Gli effetti collaterali comuni degli antibiotici per via orale comprendono la diarrea , risultante dall'interruzione della composizione delle specie nella flora intestinale , con conseguente, ad esempio, una crescita eccessiva di batteri patogeni, come il Clostridium difficile . L' assunzione di probiotici durante il trattamento antibiotico può aiutare a prevenire la diarrea associata agli antibiotici. Gli antibatterici possono anche influenzare la flora vaginale e possono portare alla crescita eccessiva di specie di lievito del genere Candida nell'area vulvo-vaginale. Ulteriori effetti collaterali possono derivare dall'interazione con altri farmaci, come la possibilità di danni ai tendini dalla somministrazione di un antibiotico chinolonico con un corticosteroide sistemico .
Alcuni antibiotici possono anche danneggiare il mitocondrio , un organello derivato da batteri che si trova nelle cellule eucariotiche, comprese quelle umane. Il danno mitocondriale causa stress ossidativo nelle cellule ed è stato suggerito come meccanismo per gli effetti collaterali dei fluorochinoloni . Sono anche noti per influenzare i cloroplasti .
Interazioni
Pillole anticoncezionali
Ci sono pochi studi ben controllati sul fatto che l'uso di antibiotici aumenti il rischio di fallimento del contraccettivo orale . La maggior parte degli studi indica che gli antibiotici non interferiscono con le pillole anticoncezionali , come gli studi clinici che suggeriscono che il tasso di fallimento delle pillole contraccettive causato dagli antibiotici è molto basso (circa l'1%). Le situazioni che possono aumentare il rischio di fallimento del contraccettivo orale includono la non conformità (mancata assunzione della pillola), vomito o diarrea. Disturbi gastrointestinali o variabilità interpaziente nell'assorbimento dei contraccettivi orali che influenzano i livelli sierici di etinilestradiolo nel sangue. Le donne con irregolarità mestruali possono essere maggiormente a rischio di fallimento e devono essere consigliate di utilizzare un contraccettivo di riserva durante il trattamento antibiotico e per una settimana dopo il suo completamento. Se si sospettano fattori di rischio specifici del paziente per una ridotta efficacia contraccettiva orale, si raccomanda la contraccezione di backup.
Nei casi in cui è stato suggerito che gli antibiotici influiscano sull'efficacia delle pillole anticoncezionali, come per la rifampicina antibiotica ad ampio spettro , questi casi possono essere dovuti a un aumento delle attività degli enzimi epatici del fegato che causano una maggiore scomposizione dei principi attivi della pillola . Sono stati anche suggeriti effetti sulla flora intestinale , che potrebbero comportare un ridotto assorbimento degli estrogeni nel colon, ma tali suggerimenti sono stati inconcludenti e controversi. I medici hanno raccomandato di applicare misure contraccettive aggiuntive durante le terapie che utilizzano antibiotici sospettati di interagire con i contraccettivi orali . Sono necessari ulteriori studi sulle possibili interazioni tra antibiotici e pillola anticoncezionale (contraccettivi orali), nonché un'attenta valutazione dei fattori di rischio specifici del paziente per il potenziale fallimento della pillola contraccettiva orale prima di respingere la necessità di un contraccettivo di riserva.
Alcool
Possono verificarsi interazioni tra alcol e alcuni antibiotici che possono causare effetti collaterali e ridotta efficacia della terapia antibiotica. Sebbene sia improbabile che un consumo moderato di alcol interferisca con molti antibiotici comuni, esistono tipi specifici di antibiotici, con i quali il consumo di alcol può causare gravi effetti collaterali. Pertanto, i potenziali rischi di effetti collaterali e di efficacia dipendono dal tipo di antibiotico somministrato.
Antibiotici come metronidazolo , tinidazolo , cephamandole , latamoxef , cefoperazone , cefmenoxime e furazolidone , causano una reazione chimica simile al disulfiram con l'alcol inibendone la degradazione da parte dell'acetaldeide deidrogenasi , che può provocare vomito, nausea e respiro corto. Inoltre, l'efficacia della doxiciclina e dell'eritromicina succinato può essere ridotta dal consumo di alcol. Altri effetti dell'alcol sull'attività antibiotica includono l'attività alterata degli enzimi epatici che scompongono il composto antibiotico.
Farmacodinamica
L'esito positivo della terapia antimicrobica con composti antibatterici dipende da diversi fattori. Questi includono i meccanismi di difesa dell'ospite , la posizione dell'infezione e le proprietà farmacocinetiche e farmacodinamiche dell'antibatterico. L'attività battericida degli antibatterici può dipendere dalla fase di crescita batterica e spesso richiede un'attività metabolica continua e la divisione delle cellule batteriche. Questi risultati si basano su studi di laboratorio e in ambito clinico hanno anche dimostrato di eliminare l'infezione batterica. Poiché l'attività degli antibatterici dipende frequentemente dalla sua concentrazione, la caratterizzazione in vitro dell'attività antibatterica include comunemente la determinazione della concentrazione inibitoria minima e della concentrazione battericida minima di un antibatterico. Per predire l'esito clinico, l'attività antimicrobica di un antibatterico è solitamente combinata con il suo profilo farmacocinetico e diversi parametri farmacologici vengono utilizzati come marcatori dell'efficacia del farmaco.
Terapia combinata
In importanti malattie infettive, inclusa la tubercolosi, la terapia combinata (cioè l'applicazione simultanea di due o più antibiotici) è stata utilizzata per ritardare o prevenire l'insorgenza di resistenza. Nelle infezioni batteriche acute, gli antibiotici come parte della terapia combinata sono prescritti per i loro effetti sinergici per migliorare l'esito del trattamento poiché l'effetto combinato di entrambi gli antibiotici è migliore del loro effetto individuale. Le infezioni da Staphylococcus aureus resistenti alla meticillina possono essere trattate con una terapia combinata di acido fusidico e rifampicina. Anche gli antibiotici usati in combinazione possono essere antagonisti e gli effetti combinati dei due antibiotici possono essere inferiori rispetto a quelli ottenuti se uno degli antibiotici fosse somministrato in monoterapia . Ad esempio, il cloramfenicolo e le tetracicline sono antagonisti delle penicilline . Tuttavia, questo può variare a seconda della specie di batteri. In generale, le combinazioni di un antibiotico batteriostatico e di un antibiotico battericida sono antagoniste.
Oltre a combinare un antibiotico con un altro, gli antibiotici sono talvolta co-somministrati con agenti che modificano la resistenza. Ad esempio, gli antibiotici β-lattamici possono essere utilizzati in combinazione con inibitori della β-lattamasi , come acido clavulanico o sulbactam , quando un paziente viene infettato da un ceppo di batteri che producono β-lattamasi .
Classi
Gli antibiotici sono comunemente classificati in base al loro meccanismo d'azione , struttura chimica o spettro di attività. La maggior parte mira alle funzioni batteriche o ai processi di crescita. Quelli che prendono di mira la parete cellulare batterica ( penicilline e cefalosporine ) o la membrana cellulare ( polimixine ) o interferiscono con gli enzimi batterici essenziali ( rifamicine , lipiarmicine , chinoloni e sulfamidici ) hanno attività battericide . Gli inibitori della sintesi proteica ( macrolidi , lincosamidi e tetracicline ) sono generalmente batteriostatici (ad eccezione degli aminoglicosidi battericidi ). Un'ulteriore categorizzazione si basa sulla loro specificità di destinazione. Gli antibiotici a "spettro stretto" prendono di mira tipi specifici di batteri, come gram-negativi o gram-positivi , mentre gli antibiotici ad ampio spettro colpiscono un'ampia gamma di batteri. Dopo un'interruzione di 40 anni nella scoperta di classi di composti antibatterici, tra la fine degli anni 2000 e l'inizio degli anni 2010 sono state introdotte quattro nuove classi di antibiotici: lipopeptidi ciclici (come la daptomicina ), glicilcicline (come la tigeciclina ), ossazolidinoni (come linezolid ) e lipiarmicine (come fidaxomicina ).
Produzione
Con i progressi della chimica medicinale , la maggior parte degli antibatterici moderni sono modificazioni semisintetiche di vari composti naturali. Questi includono, ad esempio, gli antibiotici beta-lattamici , che includono le penicilline (prodotte dai funghi del genere Penicillium ), le cefalosporine ei carbapenemi . I composti che sono ancora isolati dagli organismi viventi sono gli aminoglicosidi , mentre altri antibatterici, ad esempio i sulfonamidi , i chinoloni e gli ossazolidinoni , sono prodotti esclusivamente per sintesi chimica . Molti composti antibatterici sono molecole relativamente piccole con un peso molecolare inferiore a 1000 dalton .
Sin dai primi sforzi pionieristici di Howard Florey e Chain nel 1939, l'importanza degli antibiotici, compresi gli antibatterici, per la medicina ha portato a un'intensa ricerca sulla produzione di antibatterici su larga scala. Dopo lo screening degli antibatterici contro un'ampia gamma di batteri , la produzione dei principi attivi viene effettuata mediante fermentazione , solitamente in condizioni fortemente aerobiche .
Resistenza
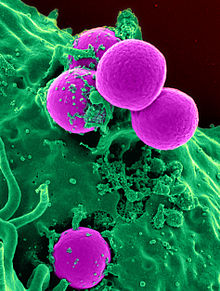
L'emergere di batteri resistenti agli antibiotici è un fenomeno comune. L'emergere di resistenza spesso riflette i processi evolutivi che hanno luogo durante la terapia antibiotica. Il trattamento antibiotico può selezionare ceppi batterici con una capacità fisiologicamente o geneticamente migliorata di sopravvivere a dosi elevate di antibiotici. In determinate condizioni, può comportare una crescita preferenziale di batteri resistenti, mentre la crescita di batteri suscettibili è inibita dal farmaco. Ad esempio, la selezione antibatterica per ceppi che avevano precedentemente acquisito geni di resistenza antibatterica è stata dimostrata nel 1943 dall'esperimento Luria-Delbrück . Antibiotici come la penicillina e l'eritromicina, che in passato avevano un'elevata efficacia contro molte specie e ceppi batterici, sono diventati meno efficaci, a causa della maggiore resistenza di molti ceppi batterici.
La resistenza può assumere la forma della biodegradazione di prodotti farmaceutici, come i batteri del suolo che degradano la sulfametazina introdotti nella sulfametazina attraverso le feci di suino medicate. La sopravvivenza dei batteri spesso deriva da una resistenza ereditaria, ma la crescita della resistenza agli antibatterici avviene anche attraverso il trasferimento genico orizzontale . È più probabile che il trasferimento orizzontale avvenga in luoghi di uso frequente di antibiotici.
La resistenza antibatterica può imporre un costo biologico, riducendo così l' idoneità dei ceppi resistenti, che possono limitare la diffusione di batteri resistenti agli antibatterici, ad esempio in assenza di composti antibatterici. Ulteriori mutazioni, tuttavia, possono compensare questo costo di fitness e possono aiutare la sopravvivenza di questi batteri.
I dati paleontologici mostrano che sia gli antibiotici che la resistenza agli antibiotici sono composti e meccanismi antichi. I bersagli antibiotici utili sono quelli per i quali le mutazioni hanno un impatto negativo sulla riproduzione o sulla vitalità batterica.
Esistono diversi meccanismi molecolari di resistenza antibatterica. La resistenza antibatterica intrinseca può far parte della composizione genetica dei ceppi batterici. Ad esempio, un bersaglio antibiotico può essere assente dal genoma batterico . La resistenza acquisita deriva da una mutazione nel cromosoma batterico o dall'acquisizione di DNA extra-cromosomico. I batteri produttori di antibatterici hanno sviluppato meccanismi di resistenza che hanno dimostrato di essere simili e potrebbero essere stati trasferiti a ceppi resistenti agli antibatterici. La diffusione della resistenza antibatterica avviene spesso attraverso la trasmissione verticale delle mutazioni durante la crescita e la ricombinazione genetica del DNA mediante scambio genetico orizzontale . Ad esempio, i geni di resistenza antibatterica possono essere scambiati tra diversi ceppi o specie batteriche tramite plasmidi che portano questi geni di resistenza. I plasmidi che trasportano diversi geni di resistenza possono conferire resistenza a più antibatterici. La resistenza crociata a diversi antibatterici può verificarsi anche quando un meccanismo di resistenza codificato da un singolo gene trasmette resistenza a più di un composto antibatterico.
I ceppi e le specie resistenti agli antibatterici, a volte indicati come "superbatteri", ora contribuiscono all'insorgere di malattie che per un po' erano ben controllate. Ad esempio, i ceppi batterici emergenti che causano la tubercolosi che sono resistenti a trattamenti antibatterici precedentemente efficaci pongono molte sfide terapeutiche. Ogni anno si stima che nel mondo si verifichino quasi mezzo milione di nuovi casi di tubercolosi multiresistente (MDR-TB). Ad esempio, NDM-1 è un enzima recentemente identificato che trasmette la resistenza batterica a un'ampia gamma di antibatterici betalattamici . La Health Protection Agency del Regno Unito ha affermato che "la maggior parte degli isolati con l'enzima NDM-1 sono resistenti a tutti gli antibiotici per via endovenosa standard per il trattamento di infezioni gravi". Il 26 maggio 2016 negli Stati Uniti è stato identificato un " superbatterio " di E. coli resistente alla colistina , antibiotico "l'ultima linea di difesa" .
Uso improprio
Per The ICU Book "La prima regola degli antibiotici è cercare di non usarli e la seconda regola è cercare di non usarne troppi". Il trattamento antibiotico inappropriato e l'uso eccessivo di antibiotici hanno contribuito all'emergere di batteri resistenti agli antibiotici. Tuttavia, il potenziale danno degli antibiotici va oltre la selezione della resistenza antimicrobica e il loro uso eccessivo è associato a effetti avversi per i pazienti stessi, osservati più chiaramente nei pazienti critici nelle unità di terapia intensiva . L'autoprescrizione di antibiotici è un esempio di uso improprio. Molti antibiotici vengono spesso prescritti per trattare sintomi o malattie che non rispondono agli antibiotici o che possono risolversi senza trattamento. Inoltre, per alcune infezioni batteriche vengono prescritti antibiotici non corretti o non ottimali. L'uso eccessivo di antibiotici, come la penicillina e l'eritromicina, è stato associato all'emergente resistenza agli antibiotici sin dagli anni '50. L'uso diffuso di antibiotici negli ospedali è stato anche associato all'aumento dei ceppi batterici e delle specie che non rispondono più al trattamento con gli antibiotici più comuni.
Le forme comuni di uso improprio di antibiotici includono l'uso eccessivo di antibiotici profilattici nei viaggiatori e l'incapacità dei professionisti medici di prescrivere il dosaggio corretto di antibiotici sulla base del peso del paziente e della storia dell'uso precedente. Altre forme di uso improprio includono la mancata assunzione dell'intero ciclo prescritto dell'antibiotico, dosaggio e somministrazione errati o mancato riposo per un recupero sufficiente. Un trattamento antibiotico inappropriato, ad esempio, è la loro prescrizione per il trattamento di infezioni virali come il comune raffreddore . Uno studio sulle infezioni del tratto respiratorio ha rilevato che "i medici erano più propensi a prescrivere antibiotici ai pazienti che sembravano aspettarseli". Interventi multifattoriali rivolti sia ai medici che ai pazienti possono ridurre la prescrizione inappropriata di antibiotici. La mancanza di test diagnostici rapidi al punto di cura, in particolare in contesti con risorse limitate, è considerata uno dei fattori trainanti dell'abuso di antibiotici.
Diverse organizzazioni che si occupano di resistenza agli antimicrobici stanno facendo pressioni per eliminare l'uso non necessario di antibiotici. I problemi dell'uso improprio e dell'uso eccessivo di antibiotici sono stati affrontati dalla formazione della US Interagency Task Force sulla resistenza antimicrobica. Questa task force mira ad affrontare attivamente la resistenza antimicrobica ed è coordinata dai Centers for Disease Control and Prevention degli Stati Uniti , dalla Food and Drug Administration (FDA) e dal National Institutes of Health , nonché da altre agenzie statunitensi. Un gruppo di campagna di un'organizzazione non governativa è Keep Antibiotics Working . In Francia, una campagna governativa "Gli antibiotici non sono automatici" è iniziata nel 2002 e ha portato a una marcata riduzione delle prescrizioni di antibiotici non necessarie, soprattutto nei bambini.
L'emergere della resistenza agli antibiotici ha imposto restrizioni al loro uso nel Regno Unito nel 1970 (rapporto Swann 1969) e l'Unione Europea ha vietato l'uso di antibiotici come agenti di promozione della crescita dal 2003. Inoltre, diverse organizzazioni (tra cui l'Organizzazione Mondiale della Sanità , la National Academy of Sciences e la Food and Drug Administration statunitense ) hanno sostenuto di limitare la quantità di uso di antibiotici nella produzione animale da cibo. Tuttavia, comunemente si verificano ritardi nelle azioni normative e legislative per limitare l'uso di antibiotici, attribuibili in parte alla resistenza contro tale regolamentazione da parte delle industrie che utilizzano o vendono antibiotici e al tempo necessario alla ricerca per testare i nessi causali tra il loro uso e la resistenza ad essi . Sono stati proposti, ma non sono stati approvati, due progetti di legge federali (S.742 e HR 2562) volti a eliminare gradualmente l'uso non terapeutico di antibiotici negli animali alimentari statunitensi. Questi progetti di legge sono stati approvati dalla sanità pubblica e dalle organizzazioni mediche, tra cui l'American Holistic Nurses' Association, l' American Medical Association e l' American Public Health Association .
Nonostante gli impegni delle aziende alimentari e dei ristoranti di ridurre o eliminare la carne proveniente da animali trattati con antibiotici, l'acquisto di antibiotici da utilizzare sugli animali da allevamento è in aumento ogni anno.
C'è stato un ampio uso di antibiotici nella zootecnia. Negli Stati Uniti, la questione dell'emergenza di ceppi batterici resistenti agli antibiotici a causa dell'uso di antibiotici nel bestiame è stata sollevata dalla Food and Drug Administration (FDA) statunitense nel 1977. Nel marzo 2012, il tribunale distrettuale degli Stati Uniti per il distretto meridionale di New York, pronunciandosi in un'azione intentata dal Consiglio per la difesa delle risorse naturali e altri, ha ordinato alla FDA di revocare le approvazioni per l'uso di antibiotici nel bestiame, che violavano i regolamenti della FDA.
Gli studi hanno dimostrato che le idee sbagliate comuni sull'efficacia e la necessità degli antibiotici per il trattamento di malattie lievi comuni contribuiscono al loro uso eccessivo.
Altre forme di danno associato agli antibiotici includono anafilassi , tossicità da farmaci , in particolare danni ai reni e al fegato e superinfezioni con organismi resistenti. Gli antibiotici sono anche noti per influenzare la funzione mitocondriale e questo può contribuire al fallimento bioenergetico delle cellule immunitarie visto nella sepsi . Inoltre alterano il microbioma dell'intestino, dei polmoni e della pelle, che può essere associato a effetti avversi come la diarrea associata al Clostridium difficile . Mentre gli antibiotici possono chiaramente salvare la vita nei pazienti con infezioni batteriche, il loro uso eccessivo, specialmente nei pazienti in cui le infezioni sono difficili da diagnosticare, possono causare danni attraverso molteplici meccanismi.
Storia
Prima dell'inizio del XX secolo, i trattamenti per le infezioni si basavano principalmente sul folklore medicinale . Miscele con proprietà antimicrobiche utilizzate nel trattamento delle infezioni sono state descritte oltre 2000 anni fa. Molte culture antiche, inclusi gli antichi egizi e gli antichi greci , utilizzavano muffe e materiali vegetali appositamente selezionati per curare le infezioni . È stato scoperto che le mummie nubiane studiate negli anni '90 contengono livelli significativi di tetraciclina . Si ipotizzava che la birra prodotta in quel momento fosse la fonte.
L'uso degli antibiotici nella medicina moderna è iniziato con la scoperta di antibiotici sintetici derivati dai coloranti.
Antibiotici sintetici derivati da coloranti
La chemioterapia antibiotica sintetica come scienza e sviluppo di antibatterici iniziò in Germania con Paul Ehrlich alla fine degli anni '80 dell'Ottocento. Ehrlich ha notato che alcuni coloranti avrebbero colorato le cellule umane, animali o batteriche, mentre altri no. Ha quindi proposto l'idea che potrebbe essere possibile creare sostanze chimiche che agirebbero come un farmaco selettivo che si legherebbe e ucciderebbe i batteri senza danneggiare l'ospite umano. Dopo aver selezionato centinaia di coloranti contro vari organismi, nel 1907, scoprì un farmaco utile in medicina, il primo composto sintetico antibatterico organoarsenico salvarsan , ora chiamato arsfenammina.
Ciò inaugurò l'era del trattamento antibatterico che iniziò con la scoperta di una serie di antibiotici sintetici derivati dall'arsenico da parte sia di Alfred Bertheim che di Ehrlich nel 1907. Ehrlich e Bertheim avevano sperimentato varie sostanze chimiche derivate dai coloranti per trattare la tripanosomiasi nei topi e l' infezione da spirocheta nei conigli. Sebbene i loro primi composti fossero troppo tossici, Ehrlich e Sahachiro Hata , un batteriologo giapponese che lavorava con Erlich nella ricerca di un farmaco per curare la sifilide , hanno ottenuto il successo con il 606° composto nella loro serie di esperimenti. Nel 1910, Ehrlich e Hata annunciarono la loro scoperta, che chiamarono il farmaco "606", al Congresso di Medicina Interna di Wiesbaden . La società Hoechst iniziò a commercializzare il composto verso la fine del 1910 con il nome di Salvarsan, ora noto come arsphenamine . Il farmaco è stato usato per curare la sifilide nella prima metà del 20° secolo. Nel 1908, Ehrlich ricevette il Premio Nobel per la Fisiologia o la Medicina per i suoi contributi all'immunologia . Hata è stato nominato per il Premio Nobel per la Chimica nel 1911 e per il Premio Nobel per la Fisiologia o la Medicina nel 1912 e 1913.
Il primo sulfamidico e il primo farmaco antibatterico ad attività sistemica , Prontosil , è stato sviluppato da un gruppo di ricerca guidato da Gerhard Domagk nel 1932 o 1933 presso i laboratori Bayer del conglomerato IG Farben in Germania, per il quale Domagk ha ricevuto nel 1939 il Premio Nobel per la Fisiologia o Medicinale. La sulfanilamide, il farmaco attivo del Prontosil, non era brevettabile in quanto era già in uso nell'industria dei coloranti da alcuni anni. Prontosil ha avuto un effetto relativamente ampio contro i cocchi Gram-positivi , ma non contro gli enterobatteri . La ricerca è stata stimolata rapidamente dal suo successo. La scoperta e lo sviluppo di questo farmaco sulfamidico ha aperto l'era degli antibatterici.
Penicillina e altri antibiotici naturali
Osservazioni sulla crescita di alcuni microrganismi che inibiscono la crescita di altri microrganismi sono state riportate dalla fine del XIX secolo. Queste osservazioni di antibiosi tra microrganismi hanno portato alla scoperta di antibatterici naturali. Louis Pasteur ha osservato, "se potessimo intervenire nell'antagonismo osservato tra alcuni batteri, offrirebbe forse le maggiori speranze terapeutiche".
Nel 1874, il medico Sir William Roberts notò che le colture della muffa Penicillium glaucum utilizzata nella produzione di alcuni tipi di formaggio blu non mostravano contaminazione batterica. Nel 1876, anche il fisico John Tyndall contribuì a questo campo.
Nel 1895 Vincenzo Tiberio , medico italiano, pubblicò un articolo sul potere antibatterico di alcuni estratti di muffa.
Nel 1897, il dottorando Ernest Duchesne presentò una tesi, " Contribution à l'étude de la concurrence vitale chez les micro-organismes: antagonisme entre les moisissures et les microbis " (Contributo allo studio della competizione vitale nei microrganismi: antagonismo tra muffe e microbi), il primo lavoro accademico noto a considerare le capacità terapeutiche delle muffe risultanti dalla loro attività antimicrobica. Nella sua tesi, Duchesne ha proposto che batteri e muffe si impegnino in una battaglia perpetua per la sopravvivenza. Duchesne ha osservato che E. coli è stato eliminato dal Penicillium glaucum quando sono stati entrambi coltivati nella stessa coltura. Ha anche osservato che quando ha inoculato animali da laboratorio con dosi letali di bacilli tifoidi insieme a Penicillium glaucum , gli animali non hanno contratto il tifo. Sfortunatamente il servizio militare di Duchesne dopo aver conseguito la laurea gli ha impedito di fare ulteriori ricerche. Duchesne morì di tubercolosi , una malattia ora curata dagli antibiotici.
Nel 1928, Sir Alexander Fleming postulò l'esistenza della penicillina , una molecola prodotta da alcune muffe che uccide o blocca la crescita di alcuni tipi di batteri. Fleming stava lavorando a una coltura di batteri patogeni quando ha notato le spore di una muffa verde, Penicillium rubens , in una delle sue piastre di coltura . Osservò che la presenza della muffa uccideva o impediva la crescita dei batteri. Fleming ipotizzò che la muffa dovesse secernere una sostanza antibatterica, che chiamò penicillina nel 1928. Fleming credeva che le sue proprietà antibatteriche potessero essere sfruttate per la chemioterapia. Inizialmente ha caratterizzato alcune delle sue proprietà biologiche e ha tentato di utilizzare un preparato grezzo per curare alcune infezioni, ma non è stato in grado di perseguire il suo ulteriore sviluppo senza l'aiuto di chimici qualificati.
Ernst Chain , Howard Florey ed Edward Abraham riuscirono a purificare la prima penicillina, la penicillina G , nel 1942, ma non divenne ampiamente disponibile al di fuori dell'esercito alleato prima del 1945. Successivamente, Norman Heatley sviluppò la tecnica di estrazione del dorso per purificare efficacemente la penicillina alla rinfusa . La struttura chimica della penicillina fu proposta per la prima volta da Abraham nel 1942 e poi confermata da Dorothy Crowfoot Hodgkin nel 1945. La penicillina purificata mostrava una potente attività antibatterica contro un'ampia gamma di batteri e aveva una bassa tossicità nell'uomo. Inoltre, la sua attività non è stata inibita da costituenti biologici come il pus, a differenza dei sulfamidici sintetici . (vedi sotto) Lo sviluppo della penicillina ha portato a un rinnovato interesse per la ricerca di composti antibiotici con efficacia e sicurezza simili. Per il loro successo nello sviluppo della penicillina, che Fleming aveva scoperto accidentalmente ma non poteva svilupparsi da solo, come farmaco terapeutico, Chain e Florey hanno condiviso il Premio Nobel per la medicina nel 1945 con Fleming.
Florey ha accreditato René Dubos come pioniere dell'approccio della ricerca deliberata e sistematica di composti antibatterici, che aveva portato alla scoperta della gramicidina e aveva rianimato la ricerca di Florey sulla penicillina. Nel 1939, in concomitanza con l'inizio della seconda guerra mondiale , Dubos aveva segnalato la scoperta del primo antibiotico di derivazione naturale, la tirotricina , un composto al 20% di gramicidina e all'80% di tirocidina , dal Bacillus brevis . È stato uno dei primi antibiotici prodotti in commercio ed è stato molto efficace nel trattamento di ferite e ulcere durante la seconda guerra mondiale. La gramicidina, tuttavia, non può essere utilizzata per via sistemica a causa della tossicità. La tirocidina si è anche rivelata troppo tossica per l'uso sistemico. I risultati della ricerca ottenuti in quel periodo non furono condivisi tra l' Asse e le potenze alleate durante la seconda guerra mondiale e l'accesso limitato durante la guerra fredda .
Fine del XX secolo
Durante la metà del XX secolo, il numero di nuove sostanze antibiotiche introdotte per uso medico è aumentato in modo significativo. Dal 1935 al 1968 furono lanciate 12 nuove classi. Tuttavia, dopo questo, il numero di nuove classi è diminuito notevolmente, con solo due nuove classi introdotte tra il 1969 e il 2003.
Pipeline di antibiotici
Sia l'OMS che la Infectious Disease Society of America riferiscono che la debole pipeline di antibiotici non corrisponde alla crescente capacità dei batteri di sviluppare resistenza. Il rapporto della Infectious Disease Society of America ha osservato che il numero di nuovi antibiotici approvati per la commercializzazione all'anno era in calo e ha identificato sette antibiotici contro i bacilli Gram-negativi attualmente in studi clinici di fase 2 o di fase 3 . Tuttavia, questi farmaci non hanno affrontato l'intero spettro di resistenza dei bacilli Gram-negativi. Secondo l'OMS cinquantuno nuove entità terapeutiche, gli antibiotici (comprese le combinazioni), sono in sperimentazione clinica di fase 1-3 a partire da maggio 2017. Gli antibiotici mirati ai patogeni Gram-positivi multiresistenti rimangono una priorità assoluta.
Alcuni antibiotici hanno ricevuto l'autorizzazione all'immissione in commercio negli ultimi sette anni. La cefalosporina ceftarolina e i lipoglicopeptidi oritavancina e telavancina per il trattamento dell'infezione batterica acuta della pelle e della struttura cutanea e della polmonite batterica acquisita in comunità. Anche il lipoglicopeptide dalbavancina e l'ossazolidinone tedizolid sono stati approvati per l'uso per il trattamento dell'infezione batterica acuta della pelle e della struttura della pelle. Il primo di una nuova classe di antibiotici macrociclici a spettro stretto , la fidaxomicina, è stato approvato per il trattamento della colite da C. difficile . Nuove combinazioni di inibitori della cefalosporina-lattamasi approvate includono anche ceftazidima-avibactam e ceftolozano-avibactam per infezioni complicate delle vie urinarie e infezioni intra-addominali.
- Ceftolozano / tazobactam (CXA-201; CXA-101/tazobactam): combinazione antipseudomonale cefalosporina / inibitore della β-lattamasi (inibitore della sintesi della parete cellulare). Approvato dalla FDA il 19 dicembre 2014.
- Ceftazidima / avibactam (ceftazidima/NXL104): combinazione antipseudomonale cefalosporina/inibitore della β-lattamasi (inibitore della sintesi della parete cellulare). Approvato dalla FDA il 25 febbraio 2015.
- Ceftarolina /avibactam (CPT-avibactam; ceftarolina/NXL104): combinazione anti- MRSA cefalosporina/inibitore della β-lattamasi (inibitore della sintesi della parete cellulare).
- Cefiderocol : sideroforo delle cefalosporine . Approvato dalla FDA il 14 novembre 2019.
- Imipenem /relebactam: combinazione carbapenem /inibitore della β-lattamasi (inibitore della sintesi della parete cellulare). Approvato dalla FDA il 16 luglio 2019.
- Meropenem/vaborbactam : combinazione carbapenem /inibitore della β-lattamasi (inibitore della sintesi della parete cellulare). Approvato dalla FDA il 29 agosto 2017.
- Delafloxacina : chinolone (inibitore della sintesi del DNA). Approvato dalla FDA il 19 giugno 2017.
- Plazomicina ( ACHN -490): derivato semisintetico dell'amminoglicoside ( inibitore della sintesi proteica ). Approvato dalla FDA il 25 giugno 2018.
- Eravaciclina (TP-434): derivato sintetico della tetraciclina (inibitore della sintesi proteica mirato ai ribosomi batterici). Approvato dalla FDA il 27 agosto 2018.
- Omadaciclina : derivato semisintetico della tetraciclina (inibitore della sintesi proteica mirato ai ribosomi batterici). Approvato dalla FDA il 2 ottobre 2018.
- Lefamulina : antibiotico della pleuromutilina. Approvato dalla FDA il 19 agosto 2019.
- Brilacidin (PMX-30063): proteina mimetica di difesa peptidica (rottura della membrana cellulare). Nella fase 2.
I possibili miglioramenti includono il chiarimento delle normative sugli studi clinici da parte della FDA. Inoltre, incentivi economici adeguati potrebbero indurre le aziende farmaceutiche a investire in questa impresa. Negli Stati Uniti, è stato introdotto l' Antibiotic Development to Advance Patient Treatment (ADAPT) Act con l'obiettivo di monitorare rapidamente lo sviluppo di farmaci di antibiotici per combattere la crescente minaccia dei "superbatteri". In base a questa legge, la FDA può approvare antibiotici e antimicotici per il trattamento di infezioni pericolose per la vita sulla base di studi clinici più piccoli. Il CDC monitorerà l'uso di antibiotici e la resistenza emergente e pubblicherà i dati. Il processo di etichettatura degli antibiotici della FDA, "Criteri interpretativi del test di sensibilità per organismi microbici" o "punti di interruzione", fornirà dati accurati agli operatori sanitari. Secondo Allan Coukell, direttore senior per i programmi sanitari presso The Pew Charitable Trusts, "Consentendo agli sviluppatori di farmaci di fare affidamento su set di dati più piccoli e chiarendo l'autorità della FDA di tollerare un livello di incertezza più elevato per questi farmaci quando si effettua un calcolo rischio/beneficio, ADAPT renderebbe le sperimentazioni cliniche più fattibili".
Rifornimento della pipeline di antibiotici e sviluppo di altre nuove terapie
Poiché i ceppi batterici resistenti agli antibiotici continuano ad emergere e diffondersi, vi è una costante necessità di sviluppare nuovi trattamenti antibatterici. Le strategie attuali includono approcci tradizionali basati sulla chimica come la scoperta di farmaci basati su prodotti naturali , nuovi approcci basati sulla chimica come la progettazione di farmaci , approcci tradizionali basati sulla biologia come la terapia con immunoglobuline e approcci sperimentali basati sulla biologia come la terapia dei fagi , microbiota fecale trapianti , trattamenti a base di RNA antisenso e trattamenti a base di CRISPR-Cas9 .
Scoperta di antibiotici a base di prodotti naturali
La maggior parte degli antibiotici attualmente in uso sono prodotti naturali o derivati di prodotti naturali e gli estratti batterici , fungini , vegetali e animali vengono selezionati alla ricerca di nuovi antibiotici. Gli organismi possono essere selezionati per i test sulla base di motivazioni ecologiche , etnomediche , genomiche o storiche . Le piante medicinali , ad esempio, vengono controllate sulla base del fatto che vengono utilizzate dai guaritori tradizionali per prevenire o curare le infezioni e possono quindi contenere composti antibatterici. Inoltre, i batteri del suolo vengono sottoposti a screening sulla base del fatto che, storicamente, sono stati una fonte molto ricca di antibiotici (con il 70-80% degli antibiotici attualmente in uso derivato dagli attinomiceti ).
Oltre allo screening dei prodotti naturali per l'attività antibatterica diretta, a volte vengono sottoposti a screening per la capacità di sopprimere la resistenza e la tolleranza agli antibiotici . Ad esempio, alcuni metaboliti secondari inibiscono le pompe di efflusso del farmaco , aumentando così la concentrazione di antibiotico in grado di raggiungere il suo bersaglio cellulare e diminuendo la resistenza batterica all'antibiotico. I prodotti naturali noti per inibire le pompe di efflusso batterico includono l' alcaloide lisergolo , i carotenoidi capsantina e capsorubina e i flavonoidi rotenone e crisina . Altri prodotti naturali, questa volta metaboliti primari piuttosto che metaboliti secondari, hanno dimostrato di sradicare la tolleranza agli antibiotici. Ad esempio, glucosio , mannitolo e fruttosio riducono la tolleranza agli antibiotici in Escherichia coli e Staphylococcus aureus , rendendoli più suscettibili all'uccisione da parte degli antibiotici aminoglicosidici .
I prodotti naturali possono essere sottoposti a screening anche per la capacità di sopprimere i fattori di virulenza batterica . I fattori di virulenza sono molecole, strutture cellulari e sistemi regolatori che consentono ai batteri di eludere le difese immunitarie dell'organismo (es . ureasi , stafiloxantina ), avvicinarsi, attaccarsi e/o invadere le cellule umane (es . pili di tipo IV , adesine , internaline ), coordinarsi l'attivazione di geni di virulenza (es. quorum sensing ) e causano malattie (es . esotossine ). Esempi di prodotti naturali con attività antivirulenza includono il flavonoide epigallocatechina gallato (che inibisce la listeriolisina O ), il chinone tetrangomicina (che inibisce la stafiloxantina) e il sesquiterpene zerumbone (che inibisce la motilità dell'Acinetobacter baumannii ).
Terapia con immunoglobuline
Gli anticorpi ( immunoglobuline antitetaniche ) sono stati utilizzati nel trattamento e nella prevenzione del tetano sin dagli anni '10 e questo approccio continua ad essere un metodo utile per controllare le malattie batteriche. L' anticorpo monoclonale bezlotoxumab , ad esempio, è stato approvato dalla FDA e dall'EMA statunitensi per l' infezione ricorrente da Clostridium difficile e sono in fase di sviluppo altri anticorpi monoclonali (ad esempio AR-301 per il trattamento aggiuntivo della polmonite associata al ventilatore da S. aureus ). I trattamenti con anticorpi agiscono legandosi e neutralizzando le esotossine batteriche e altri fattori di virulenza.
Terapia dei fagi
La terapia dei fagi è allo studio come metodo per il trattamento di ceppi di batteri resistenti agli antibiotici. La terapia fagica prevede l'infezione di agenti patogeni batterici con virus . I batteriofagi e le loro gamme ospiti sono estremamente specifici per alcuni batteri, quindi, a differenza degli antibiotici, non disturbano il microbiota intestinale dell'organismo ospite . I batteriofagi, noti anche semplicemente come fagi, infettano e uccidono i batteri principalmente durante i cicli litici. I fagi inseriscono il loro DNA nel batterio, dove viene trascritto e utilizzato per creare nuovi fagi, dopodiché la cellula si lisi, rilasciando nuovi fagi che sono in grado di infettare e distruggere altri batteri dello stesso ceppo. L'elevata specificità dei fagi protegge i batteri "buoni" dalla distruzione.
Tuttavia, esistono anche alcuni svantaggi nell'uso dei batteriofagi. I batteriofagi possono ospitare fattori di virulenza o geni tossici nei loro genomi e, prima dell'uso, può essere prudente identificare geni simili a fattori di virulenza o tossine noti mediante sequenziamento genomico. Inoltre, la somministrazione orale e endovenosa di fagi per l'eradicazione delle infezioni batteriche pone un rischio per la sicurezza molto più elevato rispetto all'applicazione topica. Inoltre, c'è l'ulteriore preoccupazione di risposte immunitarie incerte a questi grandi cocktail antigenici.
Ci sono notevoli ostacoli normativi che devono essere superati per tali terapie. Nonostante le numerose sfide, l'uso dei batteriofagi in sostituzione degli agenti antimicrobici contro i patogeni MDR che non rispondono più agli antibiotici convenzionali, rimane un'opzione interessante.
Trapianti di microbiota fecale
I trapianti di microbiota fecale comportano il trasferimento dell'intero microbiota intestinale da un donatore umano sano (sotto forma di feci ) a pazienti con infezione da C. difficile . Sebbene questa procedura non sia stata ufficialmente approvata dalla FDA statunitense , il suo utilizzo è consentito in alcune condizioni in pazienti con infezione da C. difficile resistente agli antibiotici. I tassi di guarigione sono intorno al 90% ed è in corso il lavoro per sviluppare banche delle feci , prodotti standardizzati e metodi di somministrazione orale .
Trattamenti a base di RNA antisenso
Il trattamento a base di RNA antisenso (noto anche come terapia di silenziamento genico) prevede (a) l'identificazione di geni batterici che codificano per proteine essenziali (ad esempio i geni di Pseudomonas aeruginosa acpP , lpxC e rpsJ ), (b) la sintesi di RNA a filamento singolo complementare al mRNA che codifica per queste proteine essenziali e (c) consegnando l'RNA a filamento singolo al sito di infezione utilizzando peptidi o liposomi che penetrano nelle cellule . L'RNA antisenso si ibrida quindi con l'mRNA batterico e ne blocca la traduzione nella proteina essenziale. Il trattamento a base di RNA antisenso ha dimostrato di essere efficace in modelli in vivo di polmonite da P. aeruginosa .
Oltre a silenziare i geni batterici essenziali, l'RNA antisenso può essere utilizzato per silenziare i geni batterici responsabili della resistenza agli antibiotici. Ad esempio, è stato sviluppato un RNA antisenso che silenzia il gene S. aureus mecA (il gene che codifica per la proteina modificata 2a legante la penicillina e rende i ceppi di S. aureus meticillino-resistenti ). È stato dimostrato che l' RNA antisenso mirato all'mRNA di mecA ripristina la suscettibilità degli stafilococchi resistenti alla meticillina all'oxacillina in studi sia in vitro che in vivo .
Trattamenti a base di CRISPR-Cas9
All'inizio degli anni 2000 è stato scoperto un sistema che consente ai batteri di difendersi dai virus invasori. Il sistema, noto come CRISPR-Cas9, è costituito da (a) un enzima che distrugge il DNA (la nucleasi Cas9 ) e (b) le sequenze di DNA di invasori virali precedentemente incontrati ( CRISPR ). Queste sequenze di DNA virale consentono alla nucleasi di mirare al DNA estraneo (virale) piuttosto che al DNA stesso (batterico).
Sebbene la funzione di CRISPR-Cas9 in natura sia quella di proteggere i batteri, le sequenze di DNA nel componente CRISPR del sistema possono essere modificate in modo che la nucleasi Cas9 colpisca i geni di resistenza batterica oi geni di virulenza batterica invece dei geni virali. Il sistema CRISPR-Cas9 modificato può quindi essere somministrato a patogeni batterici utilizzando plasmidi o batteriofagi. Questo approccio è stato utilizzato con successo per silenziare la resistenza agli antibiotici e ridurre la virulenza dell'E. coli enteroemorragico in un modello di infezione in vivo .
Ridurre la pressione di selezione per la resistenza agli antibiotici
Oltre a sviluppare nuovi trattamenti antibatterici, è importante ridurre la pressione selettiva per l'emergere e la diffusione della resistenza agli antibiotici . Le strategie per raggiungere questo obiettivo includono misure consolidate di controllo delle infezioni come il miglioramento delle infrastrutture (ad es. alloggi meno affollati), servizi igienico-sanitari migliori (ad es. acqua potabile e cibo sicuri) e lo sviluppo di vaccini, altri approcci come la gestione degli antibiotici e approcci sperimentali come l'uso di prebiotici e probiotici per prevenire le infezioni. Viene proposto il ciclo antibiotico, in cui gli antibiotici vengono alternati dai medici per trattare le malattie microbiche, ma studi recenti hanno rivelato che tali strategie sono inefficaci contro la resistenza agli antibiotici.
Vaccini
I vaccini si basano sull'immunomodulazione o sull'aumento . La vaccinazione eccita o rafforza la capacità immunitaria di un ospite a scongiurare l'infezione, portando all'attivazione dei macrofagi , alla produzione di anticorpi , all'infiammazione e ad altre reazioni immunitarie classiche. I vaccini antibatterici sono stati responsabili di una drastica riduzione delle malattie batteriche globali. I vaccini a base di cellule intere attenuate o lisati sono stati sostituiti in gran parte da vaccini meno reattogeni e privi di cellule costituiti da componenti purificati, inclusi polisaccaridi capsulari e loro coniugati, a vettori proteici, nonché tossine inattivate (tossoidi) e proteine.
Guarda anche
Riferimenti
Ulteriori letture
- Gould K (marzo 2016). "Antibiotici: dalla preistoria ai giorni nostri" . Il giornale della chemioterapia antimicrobica . 71 (3): 572–5. doi : 10.1093/jac/dkv484 . PMID 26851273 .
- Davies J, Davies D (settembre 2010). "Origini ed evoluzione della resistenza agli antibiotici" . Recensioni di microbiologia e biologia molecolare . 74 (3): 417–33. doi : 10.1128/MMBR.00016-10 . PMC 2937522 . PMID 20805405 .
- "Antibiotici: MedlinePlus" . nih.gov . Estratto il 19 luglio 2016 .
- "Il primo rapporto globale dell'OMS sulla resistenza agli antibiotici rivela una seria minaccia mondiale per la salute pubblica" . CHI . Archiviato dall'originale il 30 aprile 2014.
- Pugh R, Grant C, Cooke RP, Dempsey G (agosto 2015). "Terapia antibiotica di breve durata rispetto a quella prolungata per la polmonite nosocomiale negli adulti in condizioni critiche" . Il database Cochrane delle revisioni sistematiche (8): CD007577. doi : 10.1002/14651858.CD007577.pub3 . PMC 7025798 . PMID 26301604 .
- Giedraitienė A, Vitkauskienė A, Naginienė R, Pavilonis A (1 gennaio 2011). "Meccanismi di resistenza agli antibiotici di batteri clinicamente importanti" . Medicina . 47 (3): 137–46. doi : 10.3390/medicina47030019 . PMID 21822035 .
link esterno
|
Risorse della biblioteca su Antibiotico |