Astrocita - Astrocyte
| astrocita | |
|---|---|
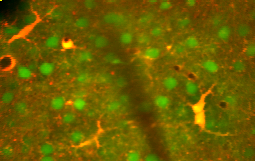
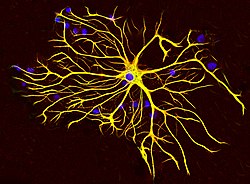 Un astrocita dal cervello di un ratto cresciuto in coltura tissutale e colorato con anticorpi contro GFAP (rosso) e vimentina (verde). Entrambe le proteine sono presenti in grandi quantità nei filamenti intermedi di questa cellula, quindi la cellula appare gialla. Il materiale blu mostra il DNA visualizzato con la colorazione DAPI e rivela il nucleo dell'astrocita e di altre cellule. Immagine per gentile concessione di EnCor Biotechnology Inc.
| |
| Particolari | |
| Posizione | Cervello e midollo spinale |
| Identificatori | |
| latino | Astrocito |
| Maglia | D001253 |
| ID NeuroLex | sao1394521419 |
| NS | H2.00.06.2.00002, H2.00.06.2.01008 |
| FMA | 54537 |
|
Termini anatomici di microanatomia | |
Gli astrociti (dal greco antico ἄστρον , ástron , "stella" + κύτος , kútos , "cavità", "cellula"), noti anche collettivamente come astroglia , sono caratteristiche cellule gliali a forma di stella nel cervello e nel midollo spinale . Svolgono molte funzioni, tra cui il supporto biochimico delle cellule endoteliali che formano la barriera emato-encefalica , la fornitura di nutrienti al tessuto nervoso, il mantenimento dell'equilibrio ionico extracellulare, la regolazione del flusso sanguigno cerebrale e un ruolo nel processo di riparazione e cicatrizzazione del cervello e midollo spinale a seguito di infezioni e lesioni traumatiche. La proporzione di astrociti nel cervello non è ben definita; a seconda della tecnica di conteggio utilizzata, gli studi hanno scoperto che la proporzione di astrociti varia in base alla regione e varia dal 20% al 40% di tutta la glia. Un altro studio riporta che gli astrociti sono il tipo di cellula più numeroso nel cervello. Gli astrociti sono la principale fonte di colesterolo nel sistema nervoso centrale. L'apolipoproteina E trasporta il colesterolo dagli astrociti ai neuroni e ad altre cellule gliali, regolando la segnalazione cellulare nel cervello. Gli astrociti nell'uomo sono più di venti volte più grandi che nei cervelli dei roditori e entrano in contatto con più di dieci volte il numero di sinapsi.
La ricerca dalla metà degli anni '90 ha dimostrato che gli astrociti propagano onde intercellulari di Ca 2+ su lunghe distanze in risposta alla stimolazione e, come i neuroni, rilasciano trasmettitori (chiamati gliotrasmettitori ) in modo Ca 2+ -dipendente. I dati suggeriscono che gli astrociti segnalino anche ai neuroni attraverso il rilascio di glutammato dipendente dal Ca 2+ . Tali scoperte hanno reso gli astrociti un'importante area di ricerca nel campo delle neuroscienze .
Struttura
Gli astrociti sono un sottotipo di cellule gliali del sistema nervoso centrale . Sono anche conosciute come cellule gliali astrocitiche. A forma di stella, i loro numerosi processi avvolgono le sinapsi prodotte dai neuroni. Nell'uomo, una singola cellula astrocitaria può interagire con un massimo di 2 milioni di sinapsi alla volta. Gli astrociti sono classicamente identificati utilizzando l' analisi istologica ; molte di queste cellule esprimono la proteina acida fibrillare gliale del filamento intermedio (GFAP). Esistono diverse forme di astrociti nel sistema nervoso centrale tra cui fibroso (nella sostanza bianca), protoplasmatico (nella sostanza grigia) e radiale . Le glia fibrose si trovano solitamente all'interno della sostanza bianca, hanno relativamente pochi organelli e mostrano lunghi processi cellulari non ramificati. Questo tipo ha spesso processi astrocitici dell'estremità del piede che collegano fisicamente le cellule all'esterno delle pareti dei capillari quando sono in prossimità di esse. Le glia protoplasmatiche sono le più diffuse e si trovano nel tessuto della sostanza grigia, possiedono una maggiore quantità di organelli e mostrano processi terziari brevi e altamente ramificati. Le cellule gliali radiali sono disposte in piani perpendicolari agli assi dei ventricoli . Uno dei loro processi confina con la pia madre , mentre l'altro è profondamente sepolto nella materia grigia. La glia radiale è per lo più presente durante lo sviluppo, svolgendo un ruolo nella migrazione dei neuroni . Le cellule di Müller della retina e le cellule gliali di Bergmann della corteccia cerebellare rappresentano un'eccezione, essendo presenti ancora durante l'età adulta. Quando in prossimità della pia madre, tutte e tre le forme di astrociti inviano processi per formare la membrana pia-gliale .
Sviluppo
Gli astrociti sono cellule macrogliali del sistema nervoso centrale. Gli astrociti derivano da popolazioni eterogenee di cellule progenitrici nel neuroepitelio del sistema nervoso centrale in via di sviluppo. C'è una notevole somiglianza tra i ben noti meccanismi genetici che specificano il lignaggio di diversi sottotipi di neuroni e quello delle cellule macrogliali. Proprio come con la specifica delle cellule neuronali, i fattori di segnalazione canonici come sonic hedgehog (SHH), fattore di crescita dei fibroblasti (FGF), WNT e proteine morfogenetiche ossee (BMP), forniscono informazioni posizionali alle cellule macrogliali in via di sviluppo attraverso gradienti morfogeni lungo il dorso-ventrale, anteriore –posteriore e mediale–laterale. Il patterning risultante lungo il neuroasse porta alla segmentazione del neuroepitelio in domini progenitori (p0, p1 p2, p3 e pMN) per tipi di neuroni distinti nel midollo spinale in via di sviluppo. Sulla base di diversi studi si ritiene ora che questo modello si applichi anche alla specificazione delle cellule macrogliali. Gli studi condotti da Hochstim e colleghi hanno dimostrato che tre distinte popolazioni di astrociti derivano dai domini p1, p2 e p3. Questi sottotipi di astrociti possono essere identificati sulla base della loro espressione di diversi fattori di trascrizione (PAX6, NKX6.1 ) e marker di superficie cellulare ( reelina e SLIT1 ). Le tre popolazioni di sottotipi di astrociti che sono state identificate sono 1) astrociti VA1 localizzati dorsalmente, derivati dal dominio p1, esprimono PAX6 e reelina 2) astrociti VA3 localizzati ventralmente, derivati da p3, esprimono NKX6.1 e SLIT1 e 3) e bianchi intermedi -astrocita VA2 localizzato nella materia, derivato dal dominio p2, che esprime PAX6, NKX6.1, reelina e SLIT1. Dopo che si è verificata la specificazione degli astrociti nel SNC in via di sviluppo, si ritiene che i precursori degli astrociti migrino nelle loro posizioni finali all'interno del sistema nervoso prima che si verifichi il processo di differenziazione terminale .
Funzione
Gli astrociti aiutano a formare la struttura fisica del cervello e si pensa che svolgano una serie di ruoli attivi, tra cui la secrezione o l'assorbimento di trasmettitori neurali e il mantenimento della barriera emato-encefalica. È stato proposto il concetto di sinapsi tripartita , riferendosi alla stretta relazione che si verifica nelle sinapsi tra un elemento presinaptico, un elemento postsinaptico e un elemento gliale.
- Strutturali : sono coinvolti nella strutturazione fisica del cervello. Gli astrociti prendono il nome perché sono "a forma di stella". Sono le cellule gliali più abbondanti nel cervello che sono strettamente associate alle sinapsi neuronali. Regolano la trasmissione degli impulsi elettrici all'interno del cervello.
- Tampone di riserva di carburante al glicogeno : gli astrociti contengono glicogeno e sono in grado di effettuare la gluconeogenesi . Gli astrociti accanto ai neuroni nella corteccia frontale e nell'ippocampo immagazzinano e rilasciano glucosio. Pertanto, gli astrociti possono alimentare i neuroni con il glucosio durante i periodi di alto tasso di consumo di glucosio e carenza di glucosio. Una recente ricerca sui ratti suggerisce che potrebbe esserci una connessione tra questa attività e l'esercizio fisico.
- Supporto metabolico : forniscono ai neuroni nutrienti come il lattato .
- Rilevamento del glucosio : normalmente associati con i neuroni, la rilevazione dei livelli di glucosio interstiziale all'interno del cervello è controllata anche da astrociti. Gli astrociti in vitro vengono attivati dal basso livello di glucosio e in vivo questa attivazione aumenta lo svuotamento gastrico per aumentare la digestione.
- Barriera emato-encefalica : si pensava che le estremità degli astrociti che circondano le cellule endoteliali aiutino a mantenere la barriera emato-encefalica , ma ricerche recenti indicano che non svolgono un ruolo sostanziale; sono invece le giunzioni strette e la lamina basale delle cellule endoteliali cerebrali che svolgono il ruolo più sostanziale nel mantenimento della barriera. Tuttavia, è stato recentemente dimostrato che l'attività degli astrociti è collegata al flusso sanguigno nel cervello e che questo è ciò che viene effettivamente misurato nella fMRI.
- Captazione e rilascio del trasmettitore : gli astrociti esprimono trasportatori di membrana plasmatica come i trasportatori del glutammato per diversi neurotrasmettitori, inclusi glutammato , ATP e GABA . Più recentemente, è stato dimostrato che gli astrociti rilasciano glutammato o ATP in modo vescicolare, Ca 2+ -dipendente. (Questo è stato contestato per gli astrociti dell'ippocampo.)
- Regolazione della concentrazione di ioni nello spazio extracellulare : gli astrociti esprimono i canali del potassio ad alta densità. Quando i neuroni sono attivi, rilasciano potassio , aumentando la concentrazione extracellulare locale. Poiché gli astrociti sono altamente permeabili al potassio, eliminano rapidamente l'accumulo in eccesso nello spazio extracellulare. Se questa funzione viene interferita, la concentrazione extracellulare di potassio aumenterà, portando alla depolarizzazione neuronale dall'equazione di Goldman . È noto che l'accumulo anomalo di potassio extracellulare determina l'attività neuronale epilettica.
- Modulazione della trasmissione sinaptica : Nel nucleo supraoptic del ipotalamo , hanno dimostrato rapidi cambiamenti astrociti morfologia incidere trasmissione heterosynaptic tra i neuroni. Nel ippocampo , astrociti sopprimono trasmissione sinaptica rilasciando ATP, che viene idrolizzato da ectonucleotidases a rendimento adenosina . L'adenosina agisce sui recettori neuronali dell'adenosina per inibire la trasmissione sinaptica, aumentando così la gamma dinamica disponibile per LTP .
- Vasomodulazione : gli astrociti possono fungere da intermediari nella regolazione neuronale del flusso sanguigno.
- Promozione dell'attività mielinizzante degli oligodendrociti : l'attività elettrica nei neuroni induce il rilascio di ATP, che funge da importante stimolo per la formazione della mielina. Tuttavia, l'ATP non agisce direttamente sugli oligodendrociti . Invece, induce gli astrociti a secernere il fattore inibitorio della leucemia della citochina (LIF), una proteina regolatrice che promuove l'attività mielinizzante degli oligodendrociti. Ciò suggerisce che gli astrociti hanno un ruolo di coordinamento esecutivo nel cervello.
- Riparazione del sistema nervoso : in caso di lesioni alle cellule nervose all'interno del sistema nervoso centrale, gli astrociti riempiono lo spazio per formare una cicatrice gliale e possono contribuire alla riparazione neurale. Tuttavia, il ruolo degli astrociti nella rigenerazione del SNC in seguito a lesioni non è ben compreso. La cicatrice gliale è stata tradizionalmente descritta come una barriera impermeabile alla rigenerazione, implicando così un ruolo negativo nella rigenerazione degli assoni. Tuttavia, recentemente, è stato scoperto attraverso studi di ablazione genetica che gli astrociti sono effettivamente necessari per la rigenerazione. Ancora più importante, gli autori hanno scoperto che la cicatrice degli astrociti è in realtà essenziale per gli assoni stimolati (quegli assoni che sono stati spinti a crescere tramite l'integrazione neurotrofica) per estendersi attraverso il midollo spinale danneggiato. Gli astrociti che sono stati spinti in un fenotipo reattivo (chiamato astrogliosi , definito dalla sovraregolazione dell'espressione di GFAP, una definizione ancora in discussione) possono effettivamente essere tossici per i neuroni, rilasciando segnali che possono uccidere i neuroni. Tuttavia, rimane molto lavoro per chiarire il loro ruolo nel danno al sistema nervoso.
- Potenziamento a lungo termine : gli scienziati discutono se gli astrociti integrano l'apprendimento e la memoria nell'ippocampo. Recentemente è stato dimostrato che l'innesto di cellule progenitrici gliali umane nei cervelli di topi nascenti farà sì che le cellule si differenziano in astrociti. Dopo la differenziazione, queste cellule aumentano l'LTP e migliorano le prestazioni della memoria nei topi.
- Orologio circadiano : gli astrociti da soli sono sufficienti per guidare le oscillazioni molecolari nel SCN e nel comportamento circadiano nei topi, e quindi possono avviare e sostenere autonomamente il comportamento complesso dei mammiferi.
- L'interruttore del sistema nervoso : Sulla base delle prove elencate di seguito, è stato recentemente ipotizzato che la macroglia (e gli astrociti in particolare) agiscano sia come condensatore neurotrasmettitore con perdita sia come interruttore logico del sistema nervoso. Cioè, le macroglia bloccano o consentono la propagazione dello stimolo lungo il sistema nervoso, a seconda del loro stato di membrana e del livello dello stimolo.
| Tipo di prova | Descrizione | Riferimenti |
|---|---|---|
| Evidenza di calcio | Le onde di calcio compaiono solo se viene superata una certa concentrazione di neurotrasmettitore | |
| Evidenze elettrofisiologiche | Un'onda negativa appare quando il livello di stimolo supera una certa soglia. La forma della risposta elettrofisiologica è diversa e ha la polarità opposta rispetto alla risposta neurale caratteristica, suggerendo che potrebbero essere coinvolte cellule diverse dai neuroni. |
|
| Evidenze psicofisiche | La risposta elettrofisiologica negativa è accompagnata da azioni tutto o niente. Una moderata risposta elettrofisiologica negativa appare nelle decisioni logiche consapevoli come i compiti di percezione. Un'onda negativa acuta e intensa appare nelle crisi epilettiche e durante i riflessi. | |
| Test di assorbimento del glutammato basati sulla radioattività | I test di assorbimento del glutammato indicano che gli astrociti processano il glutammato ad una velocità che è inizialmente proporzionale alla concentrazione di glutammato. Ciò supporta il modello del condensatore che perde, in cui la "perdita" è l'elaborazione del glutammato da parte della glutammina sintetasi della glia. Inoltre, gli stessi test indicano un livello di saturazione dopo il quale il livello di captazione del neurotrasmettitore smette di aumentare proporzionalmente alla concentrazione del neurotrasmettitore. Quest'ultimo sostiene l'esistenza di una soglia. I grafici che mostrano queste caratteristiche sono indicati come grafici di Michaelis-Menten |
Gli astrociti sono collegate da giunzioni , creando un accoppiamento elettrico (funzionale) sincizio . A causa di questa capacità degli astrociti di comunicare con i loro vicini, i cambiamenti nell'attività di un astrocita possono avere ripercussioni sulle attività di altri che sono piuttosto distanti dall'astrocita originale.
Un afflusso di ioni Ca 2+ negli astrociti è il cambiamento essenziale che alla fine genera onde di calcio. Poiché questo afflusso è causato direttamente da un aumento del flusso sanguigno al cervello, si dice che le onde di calcio siano una sorta di funzione di risposta emodinamica . Un aumento della concentrazione di calcio intracellulare può propagarsi verso l'esterno attraverso questo sincizio funzionale. I meccanismi di propagazione dell'onda di calcio includono la diffusione di ioni calcio e IP3 attraverso giunzioni gap e segnali ATP extracellulari . Gli aumenti di calcio sono il principale asse noto di attivazione negli astrociti e sono necessari e sufficienti per alcuni tipi di rilascio di glutammato astrocitico. Data l'importanza della segnalazione del calcio negli astrociti, sono stati sviluppati stretti meccanismi regolatori per la progressione della segnalazione spazio-temporale del calcio. Tramite analisi matematica è stato dimostrato che l'afflusso localizzato di ioni Ca 2+ produce un aumento localizzato della concentrazione citosolica di ioni Ca 2+ . Inoltre, l' accumulo di Ca 2+ citosolico è indipendente da ogni flusso di calcio intracellulare e dipende dallo scambio di Ca 2+ attraverso la membrana, dalla diffusione del calcio citosolico, dalla geometria della cellula, dalla perturbazione del calcio extracellulare e dalle concentrazioni iniziali.
sinapsi tripartita
All'interno del corno dorsale del midollo spinale , gli astrociti attivati hanno la capacità di rispondere a quasi tutti i neurotrasmettitori e, dopo l'attivazione, rilasciano una moltitudine di molecole neuroattive come glutammato , ATP , ossido nitrico (NO) e prostaglandine (PG), che a sua volta influenza l'eccitabilità neuronale. La stretta associazione tra astrociti e terminali presinaptici e postsinaptici , nonché la loro capacità di integrare l'attività sinaptica e rilasciare neuromodulatori, è stata definita sinapsi tripartita . La modulazione sinaptica da parte degli astrociti avviene a causa di questa associazione in tre parti.
Significato clinico
Astrocitomi
Gli astrocitomi sono tumori intracranici primari che si sviluppano dagli astrociti. È anche possibile che progenitori gliali o cellule staminali neurali possano dare origine a astrocitomi. Questi tumori possono verificarsi in molte parti del cervello e/o del midollo spinale. Gli astrocitomi si dividono in due categorie: basso grado (I e II) e alto grado (III e IV). I tumori di basso grado sono più comuni nei bambini e i tumori di alto grado sono più comuni negli adulti. Gli astrocitomi maligni sono più diffusi tra gli uomini, contribuendo a una sopravvivenza peggiore.
Gli astrocitomi pilocitici sono tumori di grado I. Sono considerati tumori benigni e a crescita lenta. Gli astrocitomi pilocitici hanno spesso porzioni cistiche piene di liquido e un nodulo, che è la porzione solida. La maggior parte si trova nel cervelletto. Pertanto, la maggior parte dei sintomi è correlata a difficoltà di equilibrio o coordinazione. Si verificano anche più frequentemente nei bambini e negli adolescenti.
Gli astrocitomi fibrillari sono tumori di II grado. Crescono in modo relativamente lento, quindi sono generalmente considerati benigni, ma si infiltrano nel tessuto sano circostante e possono diventare maligni . Gli astrocitomi fibrillari si verificano comunemente nelle persone più giovani, che spesso presentano convulsioni.
Gli astrocitomi anaplastici sono tumori maligni di grado III. Crescono più rapidamente dei tumori di grado inferiore. Gli astrocitomi anaplastici ricorrono più frequentemente dei tumori di grado inferiore perché la loro tendenza a diffondersi nel tessuto circostante li rende difficili da rimuovere completamente chirurgicamente.
Il glioblastoma multiforme è un tumore di grado IV che può originare da astrociti o da un astrocitoma esistente. Circa il 50% di tutti i tumori cerebrali sono glioblastomi. I glioblastomi possono contenere più tipi di cellule gliali, inclusi astrociti e oligodendrociti . I glioblastomi sono generalmente considerati il tipo più invasivo di tumore gliale, poiché crescono rapidamente e si diffondono ai tessuti vicini. Il trattamento può essere complicato, perché un tipo di cellula tumorale può morire in risposta a un particolare trattamento mentre gli altri tipi di cellule possono continuare a moltiplicarsi.
Disturbi del neurosviluppo
Gli astrociti sono emersi come partecipanti importanti in vari disturbi dello sviluppo neurologico . Questa visione afferma che la disfunzione degli astrociti può provocare circuiti neurali impropri, che sono alla base di alcuni disturbi psichiatrici come i disturbi dello spettro autistico e la schizofrenia .
Dolore cronico
In condizioni normali, la conduzione del dolore inizia con un segnale nocivo seguito da un potenziale d'azione trasportato da neuroni afferenti nocicettivi (sensibili al dolore), che suscitano potenziali postsinaptici eccitatori (EPSP) nel corno dorsale del midollo spinale. Quel messaggio viene quindi trasmesso alla corteccia cerebrale , dove traduciamo quegli EPSP in "dolore". Dalla scoperta della segnalazione astrocita-neurone, la nostra comprensione della conduzione del dolore è stata drammaticamente complicata. L'elaborazione del dolore non è più vista come un ripetitivo ripetitore di segnali dal corpo al cervello, ma come un sistema complesso che può essere regolato su e giù da una serie di fattori diversi. Un fattore all'avanguardia della ricerca recente è la sinapsi che potenzia il dolore situata nel corno dorsale del midollo spinale e il ruolo degli astrociti nell'incapsulare queste sinapsi. Garrison e collaboratori sono stati i primi a suggerire un'associazione quando hanno trovato una correlazione tra l' ipertrofia degli astrociti nel corno dorsale del midollo spinale e l'ipersensibilità al dolore dopo la lesione del nervo periferico, tipicamente considerata un indicatore di attivazione gliale dopo la lesione. Gli astrociti rilevano l'attività neuronale e possono rilasciare trasmettitori chimici, che a loro volta controllano l'attività sinaptica. In passato, si pensava che l' iperalgesia fosse modulata dal rilascio della sostanza P e degli aminoacidi eccitatori (EAA), come il glutammato , dalle terminazioni nervose afferenti presinaptiche nel corno dorsale del midollo spinale. Segue l'attivazione successiva di AMPA (acido α-amino-3-idrossi-5-metil-4-isossazolo propionico), NMDA (N-metil-D-aspartato) e kainato dei recettori ionotropici del glutammato . È l'attivazione di questi recettori che potenzia il segnale del dolore lungo il midollo spinale. Questa idea, sebbene vera, è una semplificazione eccessiva della trasduzione del dolore. Una litania di altri neurotrasmettitori e neuromodulatori, come il peptide correlato al gene della calcitonina (CGRP), l' adenosina trifosfato (ATP), il fattore neurotrofico derivato dal cervello (BDNF), la somatostatina , il peptide intestinale vasoattivo (VIP), la galanina e la vasopressina sono tutti sintetizzati e rilasciato in risposta a stimoli nocivi . Oltre a ciascuno di questi fattori regolatori, diverse altre interazioni tra i neuroni che trasmettono il dolore e altri neuroni nel corno dorsale hanno un impatto aggiuntivo sulle vie del dolore.
Due stati di dolore persistente
Dopo un danno persistente ai tessuti periferici si verifica il rilascio di diversi fattori dal tessuto danneggiato e dal corno dorsale spinale. Questi fattori aumentano la reattività dei neuroni di proiezione del dolore del corno dorsale agli stimoli successivi, chiamati "sensibilizzazione spinale", amplificando così l'impulso del dolore al cervello. Il rilascio di glutammato, sostanza P e peptide correlato al gene della calcitonina (CGRP) media l'attivazione di NMDAR (originariamente silenziosa perché è tappata da Mg2+), favorendo così la depolarizzazione dei neuroni postsinaptici trasmettitori del dolore (PTN). Inoltre, l'attivazione della segnalazione IP3 e delle MAPK (protein chinasi attivate da mitogeni) come ERK e JNK , determinano un aumento della sintesi di fattori infiammatori che alterano la funzione del trasportatore del glutammato. ERK inoltre attiva ulteriormente AMPAR e NMDAR nei neuroni. La nocicezione è ulteriormente sensibilizzata dall'associazione dell'ATP e della sostanza P con i rispettivi recettori (P 2 X 3 ) e il recettore della neurochinina 1 (NK1R), nonché dall'attivazione dei recettori metabotropici del glutammato e dal rilascio di BDNF. La presenza persistente di glutammato nella sinapsi determina infine una disregolazione di GLT1 e GLAST , trasportatori cruciali del glutammato negli astrociti. L'eccitazione continua può anche indurre l'attivazione di ERK e JNK, con conseguente rilascio di diversi fattori infiammatori.
Poiché il dolore nocivo è sostenuto, la sensibilizzazione spinale crea cambiamenti trascrizionali nei neuroni del corno dorsale che portano a una funzione alterata per periodi prolungati. La mobilitazione di Ca 2+ dai depositi interni deriva dalla persistente attività sinaptica e porta al rilascio di glutammato, ATP, fattore di necrosi tumorale-α (TNF-α), interleuchina 1β ( IL-1β ), IL-6, ossido nitrico (NO ), e la prostaglandina E2 (PGE2). Gli astrociti attivati sono anche una fonte di metalloproteinasi 2 della matrice ( MMP2 ), che induce la scissione della pro-IL-1β e sostiene l'attivazione degli astrociti. In questa via di segnalazione cronica, p38 viene attivato come risultato della segnalazione di IL-1β e c'è una presenza di chemochine che attivano i loro recettori per diventare attivi. In risposta al danno nervoso, le proteine da shock termico (HSP) vengono rilasciate e possono legarsi ai rispettivi TLR , portando a un'ulteriore attivazione.
Altre patologie
Altre patologie clinicamente significative che coinvolgono gli astrociti includono l' astrogliosi e l' astrocitopatia . Esempi di questi includono la sclerosi multipla , la neuromielite ottica anti-AQP4+ , l'encefalite di Rasmussen , la malattia di Alexander e la sclerosi laterale amiotrofica . Gli studi hanno dimostrato che gli astrociti possono essere implicati in malattie neurodegenerative , come il morbo di Alzheimer , il morbo di Parkinson , la malattia di Huntington , la balbuzie e la sclerosi laterale amiotrofica e nelle lesioni cerebrali acute, come l'emorragia intracerebrale e il trauma cranico.
Ricerca
Uno studio eseguito nel novembre 2010 e pubblicato nel marzo 2011, è stato condotto da un team di scienziati dell'Università di Rochester e della School of Medicine dell'Università del Colorado . Hanno fatto un esperimento per tentare di riparare il trauma al sistema nervoso centrale di un ratto adulto sostituendo le cellule gliali. Quando le cellule gliali sono state iniettate nella lesione del midollo spinale del ratto adulto, gli astrociti sono stati generati esponendo le cellule precursori gliali umane alla proteina morfogenetica ossea (la proteina morfogenetica ossea è importante perché si ritiene che crei un'architettura tissutale in tutto il corpo). Quindi, con la combinazione della proteina ossea e delle cellule gliali umane, hanno promosso un significativo recupero del posizionamento cosciente del piede, della crescita assonale e degli evidenti aumenti della sopravvivenza neuronale nelle lamine del midollo spinale . D'altra parte, le cellule precursori della glia umana e gli astrociti generati da queste cellule essendo in contatto con fattori neurotrofici ciliari , non sono riusciti a promuovere la sopravvivenza neuronale e il supporto della crescita assonale nel punto della lesione.
Uno studio condotto a Shanghai ha avuto due tipi di colture neuronali dell'ippocampo : in una coltura, il neurone è stato coltivato da uno strato di astrociti e l'altra coltura non era in contatto con alcun astrociti, ma sono stati invece alimentati con un mezzo gliale condizionato (GCM) , che nella maggior parte dei casi inibisce la rapida crescita degli astrociti in coltura nel cervello dei ratti. Nei loro risultati sono stati in grado di vedere che gli astrociti hanno un ruolo diretto nel potenziamento a lungo termine con la coltura mista (che è la coltura che è stata coltivata da uno strato di astrociti) ma non nelle colture GCM.
Gli studi hanno dimostrato che gli astrociti svolgono un'importante funzione nella regolazione delle cellule staminali neurali . La ricerca dello Schepens Eye Research Institute di Harvard mostra che il cervello umano abbonda di cellule staminali neurali, che vengono mantenute in uno stato dormiente da segnali chimici (efrina-A2 ed efrina-A3) provenienti dagli astrociti. Gli astrociti sono in grado di attivare le cellule staminali per trasformarsi in neuroni funzionanti smorzando il rilascio di efrina-A2 ed efrina-A3 .
In uno studio pubblicato in un numero del 2011 di Nature Biotechnology un gruppo di ricercatori dell'Università del Wisconsin riferisce che è stato in grado di dirigere le cellule staminali umane embrionali e indotte per diventare astrociti.
Uno studio del 2012 sugli effetti della marijuana sui ricordi a breve termine ha scoperto che il THC attiva i recettori CB1 degli astrociti che causano la rimozione dei recettori per AMPA dalle membrane dei neuroni associati.
Classificazione
Esistono diversi modi per classificare gli astrociti.
Lignaggio e fenotipo antigenico
Questi sono stati stabiliti dal lavoro classico di Raff et al. nei primi anni '80 sui nervi ottici di ratto.
- Tipo 1: Antigenicamente Ran2 + , GFAP + , FGFR3 + , A2B5 − , somigliando così all '"astrocita di tipo 1" del nervo ottico di ratto postnatale del 7° giorno. Questi possono derivare dalle cellule precursori gliali ristrette tripotenziali (GRP), ma non dalle cellule bipotenziali O2A/OPC (oligodendrociti, precursori degli astrociti di tipo 2, chiamate anche cellule progenitrici degli oligodendrociti ).
- Tipo 2: antigenicamente A2B5 + , GFAP + , FGFR3 − , Ran 2 − . Queste cellule possono svilupparsi in vitro dal GRP tripotenziale (probabilmente tramite lo stadio O2A) o da cellule O2A bipotenziali (che alcune persone {{}} pensano possano a loro volta derivare dal GRP) o in vivo quando queste cellule progenitrici vengono trapiantate nei siti della lesione (ma probabilmente non nel normale sviluppo, almeno non nel nervo ottico di ratto ). Gli astrociti di tipo 2 sono il principale componente astrocitario nelle colture di nervo ottico postnatale che sono generate da cellule O2A cresciute in presenza di siero fetale di vitello ma non si pensa esistano in vivo .
Classificazione anatomica
- Protoplasmatico: si trova nella materia grigia e ha molti processi di ramificazione le cui estremità dei piedi avvolgono le sinapsi . Alcuni astrociti protoplasmatici sono generati da cellule progenitrici multipotenti della zona subventricolare .
- Astrociti Gömöri-positivi. Questi sono un sottoinsieme di astrociti protoplasmatici che contengono numerose inclusioni citoplasmatiche, o granuli, che si colorano positivamente con la colorazione ematossilina cromo-allume di Gömöri. È ora noto che questi granuli sono formati dai resti di mitocondri degenerati inghiottiti all'interno dei lisosomi. Alcuni tipi di stress ossidativo sembrano essere responsabili del danno mitocondriale all'interno di questi astrociti specializzati. Astrociti Gömöri-positivi sono molto più abbondanti all'interno del nucleo arcuato del ipotalamo e l'ippocampo che in altre regioni del cervello. Possono avere un ruolo nella regolazione della risposta dell'ipotalamo al glucosio.
- Fibroso: si trova nella sostanza bianca e ha processi lunghi e sottili non ramificati le cui estremità dei piedi avvolgono i nodi di Ranvier . Alcuni astrociti fibrosi sono generati dalla glia radiale .
Classificazione del trasportatore/ricevitore
- Tipo GluT: esprimono i trasportatori del glutammato ( EAAT1 / SLC1A3 e EAAT2 / SLC1A2 ) e rispondono al rilascio sinaptico di glutammato da parte delle correnti di trasporto. La funzione e la disponibilità di EAAT2 sono modulate da TAAR1 , un recettore intracellulare negli astrociti umani.
- Tipo GluR: esprimono recettori del glutammato (principalmente di tipo mGluR e AMPA ) e rispondono al rilascio sinaptico di glutammato mediante correnti mediate dal canale e transitori Ca 2+ IP3- dipendenti .
Guarda anche
- Gliosi di Bergmann
- Gemistocita
- pituita
- Elenco dei tipi di cellule umane derivate dagli strati germinali
Riferimenti
Ulteriori letture
- White FA, Jung H, Miller RJ (dicembre 2007). "Chemochine e fisiopatologia del dolore neuropatico" . Atti della National Academy of Sciences degli Stati Uniti d'America . 104 (51): 20151-8. Bibcode : 2007PNAS..10420151W . doi : 10.1073/pnas.0709250104 . PMC 2154400 . PMID 18083844 .
- Milligan ED, Watkins LR (gennaio 2009). "Ruoli patologici e protettivi della glia nel dolore cronico" . Recensioni sulla natura. Neuroscienze . 10 (1): 23-36. doi : 10.1038/nrn2533 . PMC 2752436 . PMID 19096368 .
- Watkins LR, Milligan ED, Maier SF (agosto 2001). "Attivazione gliale: una forza trainante per il dolore patologico". Tendenze nelle neuroscienze . 24 (8): 450-5. doi : 10.1016/S0166-2236(00)01854-3 . PMID 11476884 . S2CID 6822068 .
- Freeman MR (novembre 2010). "Specifica e morfogenesi degli astrociti" . Scienza . 330 (6005): 774-8. Bibcode : 2010Sci...330..774F . doi : 10.1126/science.1190928 . PMC 5201129 . PMID 21051628 .
- Verkhratsky, A.; Butt, AM (2013). "Numeri: quante cellule gliali ci sono nel cervello?". Fisiologia e fisiopatologia gliale . John Wiley e figli. pp. 93-96. ISBN 978-0-470-97853-5.
- Ren H, Han R, Chen X, Liu X, Wan J, Wang L, Yang X, Wang J (maggio 2020). "Potenziali bersagli terapeutici per l'infiammazione associata all'emorragia intracerebrale: un aggiornamento" . J Cereb flusso sanguigno Metab . 40 (9): 1752-1768. doi : 10.1177/0271678X20923551 . PMC 7446569 . PMID 32423330 .