calmodulina - Calmodulin
| calmodulina | |||||||
|---|---|---|---|---|---|---|---|

| |||||||
| Identificatori | |||||||
| Simbolo | Camera | ||||||
| PDB | 1OSA | ||||||
| UniProt | P62158 | ||||||
| |||||||

Calmodulina ( CaM ) (abbreviazione di cal cium- modul ated prote in ) è un multifunzione intermedio proteina legante il calcio messaggero espresso in tutte le cellule eucariotiche . È un bersaglio intracellulare del messaggero secondario Ca 2+ e il legame di Ca 2+ è richiesto per l'attivazione della calmodulina. Una volta legata al Ca 2+ , la calmodulina agisce come parte di una via di trasduzione del segnale del calcio modificando le sue interazioni con varie proteine bersaglio come chinasi o fosfatasi .
Struttura
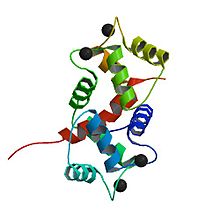
La calmodulina è una piccola proteina altamente conservata che è lunga 148 aminoacidi (16,7 kDa). La proteina ha due domini globulari approssimativamente simmetrici (i domini N e C) ciascuno contenente una coppia di motivi a mano EF separati da una regione di collegamento flessibile per un totale di quattro siti di legame Ca 2+ , due in ciascun dominio globulare. Nello stato libero da Ca 2+ , le eliche che formano le quattro mani EF sono collassate in un orientamento compatto e il linker centrale è disordinato; nello stato di saturazione di Ca 2+ , le eliche della mano EF adottano un orientamento aperto approssimativamente perpendicolare l'una all'altra, e il linker centrale forma un'alfa-elica estesa nella struttura cristallina, ma rimane ampiamente disordinata in soluzione. Il dominio C ha una maggiore affinità di legame per il Ca 2+ rispetto al dominio N.
La calmodulina è strutturalmente abbastanza simile alla troponina C , un'altra proteina legante il Ca 2+ contenente quattro motivi EF-hand. Tuttavia, la troponina C contiene un'ulteriore alfa-elica al suo N-terminale ed è costitutivamente legata al suo bersaglio, la troponina I . Pertanto, non mostra la stessa diversità di riconoscimento del bersaglio come la calmodulina.
Importanza della flessibilità nella calmodulina
La capacità di calmodulina di riconoscere una vasta gamma di proteine bersaglio è dovuta in gran parte alla sua flessibilità strutturale. Oltre alla flessibilità del dominio del linker centrale, i domini N e C subiscono un ciclo conformazionale aperto-chiuso nello stato legato al Ca 2+ . La calmodulina mostra anche una grande variabilità strutturale e subisce notevoli fluttuazioni conformazionali, quando è legata ai bersagli. Inoltre, la natura prevalentemente idrofobica del legame tra la calmodulina e la maggior parte dei suoi bersagli consente il riconoscimento di un'ampia gamma di sequenze proteiche bersaglio. Insieme, queste caratteristiche consentono alla calmodulina di riconoscere circa 300 proteine bersaglio che mostrano una varietà di motivi di sequenza che legano la CaM.
Meccanismo
Il legame del Ca 2+ da parte delle mani EF provoca un'apertura dei domini N e C, che espone superfici idrofobe di legame al bersaglio. Queste superfici interagiscono con segmenti non polari complementari su proteine bersaglio, tipicamente costituite da gruppi di amminoacidi idrofobici ingombranti separati da 10-16 amminoacidi polari e/o basici. Il dominio centrale flessibile della calmodulina consente alla proteina di avvolgersi attorno al suo bersaglio, sebbene siano note modalità alternative di legame. I bersagli "canonici" della calmodulina, come le chinasi della catena leggera della miosina e CaMKII , si legano solo alla proteina legata al Ca 2+ , mentre alcune proteine, come i canali NaV e le proteine del motivo IQ , si legano anche alla calmodulina in assenza di Ca 2+ . Il legame della calmodulina induce riarrangiamenti conformazionali nella proteina bersaglio tramite "adattamento mutuamente indotto", portando a cambiamenti nella funzione della proteina bersaglio.
Il legame del calcio da parte della calmodulina mostra una notevole cooperatività , rendendo la calmodulina un esempio insolito di una proteina legante cooperativa monomerica (a catena singola). Inoltre, il legame con il bersaglio altera l'affinità di legame della calmodulina verso gli ioni Ca 2+ , il che consente una complessa interazione allosterica tra Ca 2+ e le interazioni di legame con il bersaglio. Si ritiene che questa influenza del legame del bersaglio sull'affinità del Ca 2+ consenta l' attivazione del Ca 2+ di proteine che sono costitutivamente legate alla calmodulina, come i canali del potassio (SK) attivati dal Ca 2+ a piccola conduttanza .
Sebbene la calmodulina agisca principalmente come proteina legante il Ca 2+ , coordina anche altri ioni metallici. Ad esempio, in presenza di tipiche concentrazioni intracellulari di Mg 2+ (0,5 - 1,0 mM) e concentrazioni a riposo di Ca 2+ (100 nM), i siti di legame del Ca 2+ della calmodulina sono almeno parzialmente saturati da Mg 2+ . Questo Mg 2+ viene spostato dalle maggiori concentrazioni di Ca 2+ generate dagli eventi di segnalazione. Allo stesso modo, il Ca 2+ può essere esso stesso spostato da altri ioni metallici, come i lantanidi trivalenti, che si associano alle tasche leganti della calmodulina ancora più fortemente del Ca 2+ . Sebbene tali ioni distorcano la struttura della calmodulina e generalmente non siano fisiologicamente rilevanti a causa della loro scarsità in vitro , hanno comunque visto un ampio uso scientifico come reporter della struttura e della funzione della calmodulina.
Ruolo negli animali
La calmodulina media molti processi cruciali come l' infiammazione , il metabolismo , l' apoptosi , la contrazione della muscolatura liscia , il movimento intracellulare, la memoria a breve e lungo termine e la risposta immunitaria . Il calcio partecipa a un sistema di segnalazione intracellulare agendo come un secondo messaggero diffusibile agli stimoli iniziali. Lo fa legando vari bersagli nella cellula tra cui un gran numero di enzimi , canali ionici , acquaporine e altre proteine. La calmodulina è espressa in molti tipi cellulari e può avere diverse sedi subcellulari, compreso il citoplasma , all'interno degli organelli , o associata alle membrane plasmatiche o degli organelli, ma si trova sempre a livello intracellulare. Molte delle proteine che si lega alla calmodulina non sono in grado di legare il calcio da sole e utilizzano la calmodulina come sensore di calcio e trasduttore di segnale. La calmodulina può anche utilizzare le riserve di calcio nel reticolo endoplasmatico e nel reticolo sarcoplasmatico . La calmodulina può subire modifiche post-traduzionali, come fosforilazione , acetilazione , metilazione e scissione proteolitica , ognuna delle quali ha il potenziale per modulare le sue azioni.
Esempi specifici
Ruolo nella contrazione della muscolatura liscia
La calmodulina svolge un ruolo importante nell'accoppiamento della contrazione dell'eccitazione (EC) e nell'inizio del ciclo del ponte incrociato nella muscolatura liscia , causando infine la contrazione della muscolatura liscia. Per attivare la contrazione della muscolatura liscia, la testa della catena leggera della miosina deve essere fosforilata. Questa fosforilazione viene eseguita dalla chinasi della catena leggera della miosina (MLC) . Questa chinasi MLC viene attivata da una calmodulina quando è legata al calcio, rendendo così la contrazione della muscolatura liscia dipendente dalla presenza di calcio, attraverso il legame della calmodulina e l'attivazione della chinasi MLC.
Un altro modo in cui la calmodulina influenza la contrazione muscolare è controllando il movimento del Ca 2+ attraverso la membrana cellulare e del reticolo sarcoplasmatico . I canali del Ca 2+ , come il recettore rianodinico del reticolo sarcoplasmatico, possono essere inibiti dalla calmodulina legata al calcio, influenzando così i livelli complessivi di calcio nella cellula. Le pompe del calcio prelevano il calcio dal citoplasma o lo immagazzinano nel reticolo endoplasmatico e questo controllo aiuta a regolare molti processi a valle.
Questa è una funzione molto importante della calmodulina perché indirettamente svolge un ruolo in ogni processo fisiologico che è interessato dalla contrazione della muscolatura liscia come la digestione e la contrazione delle arterie (che aiuta a distribuire il sangue e regolare la pressione sanguigna ).
Ruolo nel metabolismo
La calmodulina svolge un ruolo importante nell'attivazione della fosforilasi chinasi , che alla fine porta alla scissione del glucosio dal glicogeno mediante la glicogeno fosforilasi .
La calmodulina svolge anche un ruolo importante nel metabolismo dei lipidi influenzando la calcitonina . La calcitonina è un ormone polipeptidico che abbassa i livelli di Ca 2+ nel sangue e attiva le cascate di proteine G che portano alla generazione di cAMP. Le azioni della calcitonina possono essere bloccate inibendo le azioni della calmodulina, suggerendo che la calmodulina svolge un ruolo cruciale nell'attivazione della calcitonina.
Ruolo nella memoria a breve e lungo termine
La proteina chinasi II Ca 2 + /calmodulina-dipendente (CaMKII) svolge un ruolo cruciale in un tipo di plasticità sinaptica nota come potenziamento a lungo termine (LTP) che richiede la presenza di calcio/calmodulina. CaMKII contribuisce alla fosforilazione di un recettore AMPA che aumenta la sensibilità dei recettori AMPA. Inoltre, la ricerca mostra che l'inibizione di CaMKII interferisce con LTP.
Ruolo nelle piante
Mentre i lieviti hanno solo un singolo gene CaM, piante e vertebrati contengono una forma evolutivamente conservata di geni CaM. La differenza tra piante e animali nella segnalazione di Ca 2+ è che le piante contengono una famiglia estesa di CaM oltre alla forma evolutivamente conservata. Le calmoduline svolgono un ruolo essenziale nello sviluppo delle piante e nell'adattamento agli stimoli ambientali.
Il calcio svolge un ruolo chiave nell'integrità strutturale della parete cellulare e del sistema di membrane della cellula. Tuttavia, elevati livelli di calcio possono essere tossici per il metabolismo energetico cellulare di una pianta e, quindi, il Ca 2+ concentrazione nel citosol è mantenuta ad un livello submicromolari rimuovendo la citosolico Ca 2+ sia al apoplast o lume degli organelli intracellulari . Gli impulsi di Ca 2+ creati a causa dell'aumento dell'afflusso e dell'efflusso agiscono come segnali cellulari in risposta a stimoli esterni come ormoni, luce, gravità, fattori di stress abiotici e anche interazioni con agenti patogeni.
Le piante contengono proteine correlate a CaM (LMC) oltre alle tipiche proteine CaM. Le LMC hanno circa il 15% di somiglianza di amminoacidi con le tipiche CaM. Arabidopsis thaliana contiene circa 50 diversi geni CML che portano alla domanda su quale scopo servano queste diverse gamme di proteine nella funzione cellulare. Tutte le specie vegetali mostrano questa diversità nei geni della LMC. Le diverse CaM e CML differiscono nella loro affinità per legare e attivare gli enzimi regolati dalle CaM in vivo . Le CaM o CML si trovano anche in diversi compartimenti di organelli.
Crescita e sviluppo delle piante
In Arabidopsis, la proteina DWF1 svolge un ruolo enzimatico nella biosintesi dei brassinosteroidi, ormoni steroidei delle piante necessari per la crescita. Si verifica un'interazione tra CaM e DWF1 e DWF1 non essendo in grado di legare CaM non è in grado di produrre un fenotipo di crescita regolare nelle piante. Quindi, CaM è essenziale per la funzione DWF1 nella crescita delle piante.
È noto anche che le proteine leganti la CaM regolano lo sviluppo riproduttivo nelle piante. Ad esempio, la proteina chinasi che lega la CaM nel tabacco agisce come un regolatore negativo della fioritura. Tuttavia, queste proteine chinasi leganti la CaM sono presenti anche nel meristema apicale del germoglio del tabacco e un'alta concentrazione di queste chinasi nel meristema provoca una transizione ritardata alla fioritura nella pianta.
La chinasi del recettore S- locus (SRK) è un'altra proteina chinasi che interagisce con CaM. SRK è coinvolto nelle risposte di autoincompatibilità coinvolte nelle interazioni polline-pistillo in Brassica .
I bersagli di CaM in Arabidopsis sono anche coinvolti nello sviluppo e nella fecondazione del polline. I trasportatori di Ca 2+ sono essenziali per la crescita del tubo pollinico . Quindi, un gradiente costante di Ca 2+ viene mantenuto all'apice del tubo pollinico per l'allungamento durante il processo di fecondazione. Allo stesso modo, CaM è essenziale anche all'apice del tubo pollinico, dove il suo ruolo principale riguarda la guida della crescita del tubo pollinico.
Interazione con i microbi
Formazione di noduli
Ca 2+ svolge un ruolo significativamente importante nella formazione dei noduli nei legumi. L'azoto è un elemento essenziale richiesto nelle piante e molti legumi, incapaci di fissare l'azoto in modo indipendente, si accoppiano in simbiosi con i batteri che fissano l'azoto che riducono l'azoto ad ammoniaca. Questo stabilimento di interazione legume- Rhizobium richiede il fattore Nod prodotto dai batteri Rhizobium . Il fattore Nod è riconosciuto dalle cellule ciliate della radice che sono coinvolte nella formazione dei noduli nei legumi. Risposte Ca 2+ di varia natura sono caratterizzate per essere coinvolte nel riconoscimento del fattore Nod. C'è un flusso di Ca 2+ sulla punta dei capelli della radice inizialmente seguito da un'oscillazione ripetitiva di Ca 2+ nel citosol e anche un picco di Ca 2+ si verifica attorno al nucleo. DMI3, un gene essenziale per le funzioni di segnalazione del fattore Nod a valle della firma di spiking di Ca 2+ , potrebbe riconoscere la firma di Ca 2+ . Inoltre, diversi geni CaM e CML in Medicago e Lotus sono espressi nei noduli.
Difesa da agenti patogeni
Tra la vasta gamma di strategie di difesa che le piante utilizzano contro i patogeni, la segnalazione di Ca 2+ è sempre più comune. I livelli di Ca 2+ libero nel citoplasma aumentano in risposta a un'infezione patogena. Le firme di Ca 2+ di questa natura di solito attivano il sistema di difesa della pianta inducendo geni correlati alla difesa e la morte delle cellule ipersensibili. CaM, CML e proteine che legano CaM sono alcuni degli elementi recentemente identificati delle vie di segnalazione di difesa delle piante. Diversi geni CML nel tabacco , nei fagioli e nei pomodori sono sensibili agli agenti patogeni. CML43 è una proteina correlata alla CaM che, come isolata dal gene APR134 nelle foglie resistenti alle malattie di Arabidopsis per l'analisi dell'espressione genica, viene rapidamente indotta quando le foglie vengono inoculate con Pseudomonas syringae . Questi geni si trovano anche nei pomodori ( Solanum lycopersicum ). Il CML43 dell'APR134 si lega anche agli ioni Ca 2+ in vitro, il che mostra che CML43 e APR134 sono, quindi, coinvolti nella segnalazione Ca 2+ -dipendente durante la risposta immunitaria della pianta ai patogeni batterici. L'espressione di CML9 in Arabidopsis thaliana è rapidamente indotta da batteri fitopatogeni, flagellina e acido salicilico. Espressione di soia SCaM4 e SCaM5 in transgeniche di tabacco e Arabidopsis provoca un'attivazione di geni correlati alla resistenza patogeno e si traduce anche in una maggiore resistenza ad un ampio spettro di infezione patogeno. Lo stesso non vale per la soia SCaM1 e SCaM2 che sono isoforme CaM altamente conservate. La proteina At BAG6 è una proteina legante la CaM che si lega alla CaM solo in assenza di Ca 2+ e non in presenza di esso. A BAG6 è responsabile della risposta ipersensibile della morte cellulare programmata al fine di prevenire la diffusione dell'infezione da agenti patogeni o per limitare la crescita dei patogeni. Le mutazioni nelle proteine leganti la CaM possono portare a gravi effetti sulla risposta di difesa delle piante nei confronti delle infezioni da patogeni. I canali ciclici nucleotide-dipendenti (CNGC) sono canali proteici funzionali nella membrana plasmatica che hanno siti di legame CaM sovrapposti che trasportano cationi bivalenti come Ca 2+ . Tuttavia, il ruolo esatto del posizionamento dei CNGC in questo percorso per la difesa delle piante non è ancora chiaro.
Risposta allo stress abiotico nelle piante
Il cambiamento nei livelli intracellulari di Ca 2+ viene utilizzato come firma per diverse risposte a stimoli meccanici, trattamenti osmotici e salini e shock da freddo e calore. Diversi tipi di cellule radicali mostrano una diversa risposta del Ca 2+ agli stress osmotici e salini e questo implica le specificità cellulari dei modelli di Ca 2+ . In risposta allo stress esterno, la CaM attiva la glutammato decarbossilasi (GAD) che catalizza la conversione di L- glutammato in GABA. Uno stretto controllo sulla sintesi del GABA è importante per lo sviluppo delle piante e, quindi, un aumento dei livelli di GABA può essenzialmente influenzare lo sviluppo delle piante. Pertanto, lo stress esterno può influenzare la crescita e lo sviluppo delle piante e le CaM sono coinvolte in quel percorso che controlla questo effetto.
Esempi di piante
sorgo
Il sorgo vegetale è un organismo modello ben consolidato e può adattarsi in ambienti caldi e secchi. Per questo motivo viene utilizzato come modello per studiare il ruolo della calmodulina nelle piante. Sorgo contiene piantine che esprimono una glicina ricchi di proteine RNA-binding , SbGRBP. Questa particolare proteina può essere modulata utilizzando il calore come fattore di stress. La sua posizione unica nel nucleo cellulare e nel citosol dimostra l'interazione con la calmodulina che richiede l'uso di Ca 2+ . Esponendo la pianta a condizioni di stress versatili , può causare la repressione di diverse proteine che consentono alle cellule vegetali di tollerare i cambiamenti ambientali. È stato dimostrato che queste proteine dello stress modulato interagiscono con CaM. I geni CaMBP espressi nel sorgo sono descritti come una "coltura modello" per la ricerca della tolleranza allo stress da calore e siccità .
Arabidopsis
In uno studio di Arabidopsis thaliana , centinaia di proteine diverse hanno dimostrato la possibilità di legarsi a CaM nelle piante.
Membri della famiglia
- Calmodulina 1 ( CALM1 )
- Calmodulina 2 ( CALM2 )
- Calmodulina 3 ( CALM3 )
- calmodulina 1 pseudogene 1 ( CALM1P1 )
- Calmodulina-simile 3 ( CALML3 )
- Simile alla calmodulina 4 ( CALML4 )
- Simil-calmodulina 5 ( CALML5 )
- Simile alla calmodulina 6 ( CALML6 )
Altre proteine che legano il calcio
La calmodulina appartiene a uno dei due gruppi principali di proteine leganti il calcio, chiamate proteine della mano EF . L'altro gruppo, chiamato annessine , lega calcio e fosfolipidi come la lipocortina . Molte altre proteine legano il calcio, sebbene il legame del calcio possa non essere considerato la loro funzione principale nella cellula.
Guarda anche
- Pagina di proteopedia per Calmodulin e il suo cambiamento conformazionale
- Chinasi proteica
- Proteina chinasi Ca 2 + /calmodulina-dipendente
Riferimenti
link esterno
- "Glicoproteina associata alla mielina" . Molecola del mese . RCSB PDB. Luglio 2020. Archiviato dall'originale il 29-05-2010 . Estratto 2021-06-19 .
- Nelson M, Chazin W. "Home Page per Calmodulin" . Libreria dati sulle proteine leganti il calcio EF-Hand . Università di Vanderbilt . Estratto 22-03-2008 .
- Ikura M (2000). "Calmodulin Target Database" . Giornale di genomica strutturale e funzionale . Ontario Cancer Institute, Università di Toronto. 1 (1): 8-14. doi : 10.1023/a:1011320027914 . PMID 12836676 . S2CID 23097597 . Estratto 22-03-2008 .
- Calmodulin presso la National Library of Medicine degli Stati Uniti Medical Subject Headings (MeSH)
- InterPro : IPR015754