Chimica - Chemistry
| Parte di una serie su |
| Chimica |
|---|

|
|
La chimica è lo studio scientifico delle proprietà e del comportamento della materia . È una scienza naturale che copre gli elementi che compongono la materia fino ai composti composti da atomi , molecole e ioni : la loro composizione, struttura, proprietà, comportamento e le modificazioni che subiscono durante una reazione con altre sostanze .
Nell'ambito della sua disciplina, la chimica occupa una posizione intermedia tra la fisica e la biologia . A volte è chiamata la scienza centrale perché fornisce una base per comprendere le discipline scientifiche di base e applicate a un livello fondamentale. Ad esempio, la chimica spiega gli aspetti della chimica delle piante ( botanica ), la formazione delle rocce ignee ( geologia ), come si forma l'ozono atmosferico e come vengono degradati gli inquinanti ambientali ( ecologia ), le proprietà del suolo sulla luna ( cosmochimica ), come i farmaci funzionano ( farmacologia ) e come raccogliere prove del DNA sulla scena del crimine ( medicina legale ).
La chimica affronta argomenti come il modo in cui atomi e molecole interagiscono tramite legami chimici per formare nuovi composti chimici . Esistono due tipi di legami chimici: 1. legami chimici primari es. legami covalenti , in cui gli atomi condividono uno o più elettroni; legami ionici , in cui un atomo dona uno o più elettroni ad un altro atomo per produrre ioni ( cationi e anioni ); legami metallici e 2. legami chimici secondari es. legami idrogeno ; Legami di forza di Van der Waals , interazione ione-ione, interazione ione-dipolo ecc.
Etimologia
La parola chimica deriva da una modifica della parola alchimia , che si riferiva a un precedente insieme di pratiche che comprendevano elementi di chimica, metallurgia , filosofia , astrologia , astronomia , misticismo e medicina . L'alchimia è spesso vista come collegata alla ricerca di trasformare il piombo o altri metalli di base in oro, sebbene anche gli alchimisti fossero interessati a molte delle questioni della chimica moderna.
La parola moderna alchimia a sua volta deriva dalla parola araba al-kīmīā ( الكیمیاء ). Questo potrebbe avere origini egiziane poiché al-kīmīā deriva dal greco antico χημία , a sua volta derivato dalla parola Kemet , che è l'antico nome dell'Egitto in lingua egiziana. In alternativa, al-kīmīā potrebbe derivare da χημεία ' mettere insieme'.
Principi moderni
L'attuale modello di struttura atomica è il modello quantomeccanico . La chimica tradizionale inizia con lo studio di particelle elementari , atomi , molecole , sostanze , metalli , cristalli e altri aggregati di materia . Questione può essere studiato in solidi, liquidi, gas e plasma stati , singolarmente o in combinazione. Le interazioni , le reazioni e le trasformazioni studiate in chimica sono solitamente il risultato di interazioni tra atomi, che portano a riarrangiamenti dei legami chimici che tengono insieme gli atomi. Tali comportamenti sono studiati in un laboratorio di chimica .
Il laboratorio di chimica utilizza stereotipicamente varie forme di vetreria da laboratorio . Tuttavia, la vetreria non è fondamentale per la chimica e gran parte della chimica sperimentale (oltre a quella applicata/industriale) viene eseguita senza di essa.

Una reazione chimica è una trasformazione di alcune sostanze in una o più sostanze diverse. La base di tale trasformazione chimica è il riarrangiamento degli elettroni nei legami chimici tra gli atomi. Può essere rappresentato simbolicamente attraverso un'equazione chimica , che di solito coinvolge gli atomi come soggetti. Il numero di atomi a sinistra ea destra nell'equazione per una trasformazione chimica è uguale. (Quando il numero di atomi su entrambi i lati è diseguale, la trasformazione è indicata come reazione nucleare o decadimento radioattivo .) Il tipo di reazioni chimiche che una sostanza può subire e i cambiamenti energetici che possono accompagnarla sono vincolati da alcune regole di base, note come leggi chimiche .
Le considerazioni sull'energia e sull'entropia sono invariabilmente importanti in quasi tutti gli studi chimici. Le sostanze chimiche sono classificate in base alla loro struttura , fase e composizione chimica . Possono essere analizzati utilizzando gli strumenti dell'analisi chimica , ad esempio la spettroscopia e la cromatografia . Gli scienziati impegnati nella ricerca chimica sono conosciuti come chimici . La maggior parte dei chimici è specializzata in una o più sotto-discipline. Diversi concetti sono essenziali per lo studio della chimica; alcuni di loro sono:
Questione
In chimica, la materia è definita come tutto ciò che ha massa e volume a riposo (occupa spazio) ed è costituito da particelle . Anche le particelle che compongono la materia hanno massa a riposo: non tutte le particelle hanno massa a riposo, come il fotone . La materia può essere una sostanza chimica pura o una miscela di sostanze.
Atomo

L'atomo è l'unità di base della chimica. Consiste in un nucleo denso chiamato nucleo atomico circondato da uno spazio occupato da una nuvola di elettroni . Il nucleo è costituito da protoni con carica positiva e neutroni senza carica (chiamati insieme nucleoni ), mentre la nuvola di elettroni è costituita da elettroni con carica negativa che orbitano attorno al nucleo. In un atomo neutro, gli elettroni con carica negativa bilanciano la carica positiva dei protoni. Il nucleo è denso; la massa di un nucleone è circa 1.836 volte quella di un elettrone, ma il raggio di un atomo è circa 10.000 volte quello del suo nucleo.
L'atomo è anche l'entità più piccola che può essere prevista per mantenere le proprietà chimiche dell'elemento, come elettronegatività , potenziale di ionizzazione , stato di ossidazione preferito , numero di coordinazione e tipi preferiti di legami da formare (ad esempio, metallico , ionico , covalente ).
Elemento
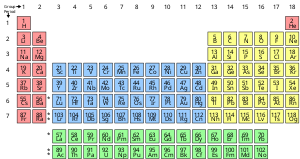
Un elemento chimico è una sostanza pura che è composta da un solo tipo di atomo, caratterizzato dal suo particolare numero di protoni nei nuclei dei suoi atomi, noto come numero atomico e rappresentato dal simbolo Z . Il numero di massa è la somma del numero di protoni e neutroni in un nucleo. Sebbene tutti i nuclei di tutti gli atomi appartenenti a un elemento avranno lo stesso numero atomico, potrebbero non avere necessariamente lo stesso numero di massa; gli atomi di un elemento che hanno un numero di massa diverso sono noti come isotopi . Ad esempio, tutti gli atomi con 6 protoni nei loro nuclei sono atomi dell'elemento chimico carbonio , ma gli atomi di carbonio possono avere un numero di massa di 12 o 13.
La presentazione standard degli elementi chimici è nella tavola periodica , che ordina gli elementi per numero atomico. La tavola periodica è organizzata in gruppi , o colonne, e periodi , o righe. La tavola periodica è utile per identificare le tendenze periodiche .
Composto

Un composto è una sostanza chimica pura composta da più di un elemento. Le proprietà di un composto hanno poche somiglianze con quelle dei suoi elementi. La nomenclatura standard dei composti è stabilita dalla International Union of Pure and Applied Chemistry (IUPAC). I composti organici sono denominati secondo il sistema di nomenclatura organica . I nomi dei composti inorganici sono creati secondo il sistema di nomenclatura inorganica . Quando un composto ha più di un componente, allora sono divisi in due classi, i componenti elettropositivi ed elettronegativi. Inoltre, il Chemical Abstracts Service ha ideato un metodo per indicizzare le sostanze chimiche. In questo schema ogni sostanza chimica è identificabile da un numero noto come numero di registro CAS .
Molecola

Una molecola è la più piccola porzione indivisibile di una sostanza chimica pura che ha il suo insieme unico di proprietà chimiche, cioè il suo potenziale per subire un certo insieme di reazioni chimiche con altre sostanze. Tuttavia, questa definizione funziona bene solo per le sostanze composte da molecole, il che non è vero per molte sostanze (vedi sotto). Le molecole sono tipicamente un insieme di atomi legati insieme da legami covalenti , in modo tale che la struttura sia elettricamente neutra e tutti gli elettroni di valenza siano accoppiati con altri elettroni sia in legami che in coppie solitarie .
Pertanto, le molecole esistono come unità elettricamente neutre, a differenza degli ioni. Quando questa regola viene infranta, dando alla "molecola" una carica, il risultato viene talvolta chiamato ione molecolare o ione poliatomico. Tuttavia, la natura discreta e separata del concetto molecolare di solito richiede che gli ioni molecolari siano presenti solo in forma ben separata, come un raggio diretto nel vuoto in uno spettrometro di massa . Le raccolte poliatomiche cariche che risiedono nei solidi (ad esempio, i comuni ioni solfato o nitrato) non sono generalmente considerate "molecole" in chimica. Alcune molecole contengono uno o più elettroni spaiati, creando radicali . La maggior parte dei radicali è relativamente reattiva, ma alcuni, come l'ossido nitrico (NO), possono essere stabili.
Gli elementi "inerti" o gas nobili ( elio , neon , argon , krypton , xeno e radon ) sono composti da atomi solitari come la loro più piccola unità discreta, ma gli altri elementi chimici isolati sono costituiti da molecole o reti di atomi legati tra loro in qualche modo. Le molecole identificabili compongono sostanze familiari come acqua, aria e molti composti organici come alcol, zucchero, benzina e vari prodotti farmaceutici .
Tuttavia, non tutte le sostanze o i composti chimici sono costituiti da molecole discrete, e infatti la maggior parte delle sostanze solide che compongono la crosta solida, il mantello e il nucleo della Terra sono composti chimici senza molecole. Questi altri tipi di sostanze, come i composti ionici e i solidi reticolari , sono organizzati in modo tale da non avere l'esistenza di molecole identificabili di per sé . Invece, queste sostanze sono discusse in termini di unità formula o celle unitarie come la più piccola struttura ripetitiva all'interno della sostanza. Esempi di tali sostanze sono sali minerali (come il sale da cucina ), solidi come carbonio e diamante, metalli e minerali familiari di silice e silicato come quarzo e granito.
Una delle caratteristiche principali di una molecola è la sua geometria, spesso chiamata struttura . Mentre la struttura delle molecole biatomiche, triatomiche o tetraatomiche può essere banale (lineare, angolare piramidale ecc.) la struttura delle molecole poliatomiche, che sono costituite da più di sei atomi (di più elementi) può essere cruciale per la sua natura chimica .
Sostanza e miscela
 
| |
 
| |
 
| |
| Esempi di sostanze chimiche pure. Da sinistra a destra: gli elementi stagno (Sn) e zolfo (S), diamante (un allotropo del carbonio ), saccarosio (zucchero puro), cloruro di sodio (sale) e bicarbonato di sodio (bicarbonato di sodio), che sono entrambi composti ionici . |
Una sostanza chimica è un tipo di materia con una composizione definita e un insieme di proprietà . Un insieme di sostanze è chiamato miscela. Esempi di miscele sono aria e leghe .
Talpa e quantità di sostanza
La talpa è un'unità di misura che denota una quantità di sostanza (detta anche quantità chimica). Una mole è definita per contenere esattamente6.022 140 76 × 10 23 particelle ( atomi , molecole , ioni o elettroni ), dove il numero di particelle per mole è noto come costante di Avogadro . La concentrazione molare è la quantità di una particolare sostanza per volume di soluzione ed è comunemente riportata in mol/ dm 3 .
Fase
Oltre alle proprietà chimiche specifiche che contraddistinguono le diverse classificazioni chimiche, le sostanze chimiche possono esistere in più fasi. Per la maggior parte, le classificazioni chimiche sono indipendenti da queste classificazioni in fase di massa; tuttavia, alcune fasi più esotiche sono incompatibili con determinate proprietà chimiche. Una fase è un insieme di stati di un sistema chimico che hanno proprietà strutturali di massa simili, in una serie di condizioni, come la pressione o la temperatura .
Le proprietà fisiche, come la densità e l'indice di rifrazione, tendono a rientrare nei valori caratteristici della fase. La fase della materia è definita dalla transizione di fase , ovvero quando l'energia immessa o prelevata dal sistema va a riorganizzare la struttura del sistema, invece di modificare le condizioni di massa.
A volte la distinzione tra le fasi può essere continua invece di avere un confine discreto' in questo caso la materia è considerata in uno stato supercritico . Quando tre stati si incontrano in base alle condizioni, è noto come punto triplo e poiché questo è invariante, è un modo conveniente per definire un insieme di condizioni.
Gli esempi più familiari di fasi sono solidi , liquidi e gas . Molte sostanze presentano più fasi solide. Ad esempio, ci sono tre fasi del ferro solido (alfa, gamma e delta) che variano in base alla temperatura e alla pressione. Una differenza principale tra le fasi solide è la struttura cristallina , o disposizione, degli atomi. Un'altra fase che si incontra comunemente nello studio della chimica è la fase acquosa , che è lo stato delle sostanze disciolte in soluzione acquosa (cioè in acqua).
Le fasi meno familiari includono plasmi , condensati di Bose-Einstein e condensati fermionici e le fasi paramagnetiche e ferromagnetiche dei materiali magnetici . Mentre le fasi più familiari riguardano i sistemi tridimensionali, è anche possibile definire analoghi nei sistemi bidimensionali, che ha ricevuto attenzione per la sua rilevanza per i sistemi in biologia .
legame

Si dice che gli atomi che si uniscono in molecole o cristalli siano legati tra loro. Un legame chimico può essere visualizzato come l' equilibrio multipolare tra le cariche positive nei nuclei e le cariche negative che oscillano intorno ad essi. Più che semplice attrazione e repulsione, le energie e le distribuzioni caratterizzano la disponibilità di un elettrone a legarsi ad un altro atomo.
Un legame chimico può essere un legame covalente , un legame ionico , un legame idrogeno o semplicemente a causa della forza di Van der Waals . Ciascuno di questi tipi di legami è attribuito a un potenziale. Questi potenziali creano le interazioni che tengono insieme gli atomi in molecole o cristalli . In molti composti semplici, la teoria del legame di valenza , il modello Valence Shell Electron Pair Repulsion ( VSEPR ) e il concetto di numero di ossidazione possono essere utilizzati per spiegare la struttura e la composizione molecolare.
Un legame ionico si forma quando un metallo perde uno o più dei suoi elettroni, diventando un catione con carica positiva, e gli elettroni vengono quindi acquisiti dall'atomo non metallico, diventando un anione con carica negativa. I due ioni di carica opposta si attraggono e il legame ionico è la forza di attrazione elettrostatica tra di loro. Ad esempio, il sodio (Na), un metallo, perde un elettrone per diventare un catione Na + mentre il cloro (Cl), un non metallo, guadagna questo elettrone per diventare Cl - . Gli ioni sono tenuti insieme a causa dell'attrazione elettrostatica e si forma quel composto cloruro di sodio (NaCl), o sale da tavola comune.

In un legame covalente, una o più coppie di elettroni di valenza sono condivise da due atomi: il gruppo di atomi legati elettricamente neutro risultante è chiamato molecola . Gli atomi condivideranno gli elettroni di valenza in modo tale da creare una configurazione elettronica di gas nobile (otto elettroni nel loro guscio più esterno) per ogni atomo. Si dice che gli atomi che tendono a combinarsi in modo tale da avere ciascuno otto elettroni nel loro guscio di valenza seguano la regola dell'ottetto . Tuttavia, alcuni elementi come l' idrogeno e il litio hanno bisogno solo di due elettroni nel loro guscio più esterno per raggiungere questa configurazione stabile; si dice che questi atomi seguano la regola del duetto , e in questo modo stanno raggiungendo la configurazione elettronica del gas nobile elio , che ha due elettroni nel suo guscio esterno.
Allo stesso modo, le teorie della fisica classica possono essere utilizzate per prevedere molte strutture ioniche. Con composti più complicati, come i complessi metallici , la teoria del legame di valenza è meno applicabile e vengono generalmente utilizzati approcci alternativi, come la teoria degli orbitali molecolari . Vedi diagramma sugli orbitali elettronici.
Energia
Nel contesto della chimica, l'energia è un attributo di una sostanza come conseguenza della sua atomico , molecolare o aggregato struttura . Poiché una trasformazione chimica è accompagnata da una variazione di uno o più di questi tipi di strutture, è sempre accompagnato da un aumento o diminuzione di energia delle sostanze coinvolte. Una certa energia viene trasferita tra l'ambiente circostante ei reagenti della reazione sotto forma di calore o luce ; quindi i prodotti di una reazione possono avere più o meno energia dei reagenti.
Una reazione si dice esoergonica se lo stato finale è inferiore sulla scala dell'energia rispetto allo stato iniziale; nel caso delle reazioni endoergoniche la situazione è opposta. Una reazione si dice esotermica se la reazione cede calore all'ambiente circostante; nel caso di reazioni endotermiche , la reazione assorbe calore dall'ambiente circostante.
Le reazioni chimiche non sono invariabilmente possibili a meno che i reagenti non superino una barriera energetica nota come energia di attivazione . La velocità di una reazione chimica (a una data temperatura T) è correlata all'energia di attivazione E, dal fattore di popolazione di Boltzmann, che è la probabilità che una molecola abbia energia maggiore o uguale a E alla data temperatura T. Questo esponenziale la dipendenza della velocità di reazione dalla temperatura è nota come equazione di Arrhenius . L'energia di attivazione necessaria per il verificarsi di una reazione chimica può essere sotto forma di calore, luce, elettricità o forza meccanica sotto forma di ultrasuoni .
Un concetto correlato di energia libera , che incorpora anche considerazioni sull'entropia, è un mezzo molto utile per prevedere la fattibilità di una reazione e determinare lo stato di equilibrio di una reazione chimica, in termodinamica chimica . Una reazione è fattibile solo se la variazione totale dell'energia libera di Gibbs è negativa, ; se è uguale a zero la reazione chimica si dice all'equilibrio .
Esistono solo stati possibili limitati di energia per elettroni, atomi e molecole. Questi sono determinati dalle regole della meccanica quantistica , che richiedono la quantizzazione dell'energia di un sistema legato. Si dice che gli atomi/molecole in uno stato energetico superiore sono eccitati. Le molecole/atomi di sostanza in uno stato energetico eccitato sono spesso molto più reattive; cioè, più suscettibile alle reazioni chimiche.
La fase di una sostanza è invariabilmente determinata dalla sua energia e dall'energia dell'ambiente circostante. Quando le forze intermolecolari di una sostanza sono tali che l'energia dell'ambiente non è sufficiente a superarle, essa si presenta in una fase più ordinata come quella liquida o solida come nel caso dell'acqua (H 2 O); un liquido a temperatura ambiente perché le sue molecole sono legate da legami idrogeno . Considerando che l' idrogeno solforato (H 2 S) è un gas a temperatura ambiente e pressione standard, poiché le sue molecole sono legate da interazioni dipolo-dipolo più deboli .
Il trasferimento di energia da una sostanza chimica a un'altra dipende dalla dimensione dei quanti di energia emessi da una sostanza. Tuttavia, l'energia termica viene spesso trasferita più facilmente da quasi tutte le sostanze a un'altra perché i fononi responsabili dei livelli di energia vibrazionale e rotazionale in una sostanza hanno molta meno energia dei fotoni invocati per il trasferimento di energia elettronica. Pertanto, poiché i livelli di energia vibrazionale e rotazionale sono più ravvicinati dei livelli di energia elettronica, il calore viene trasferito più facilmente tra le sostanze rispetto alla luce o ad altre forme di energia elettronica. Ad esempio, la radiazione elettromagnetica ultravioletta non viene trasferita da una sostanza all'altra con la stessa efficacia dell'energia termica o elettrica.
L'esistenza di livelli energetici caratteristici per diverse sostanze chimiche è utile per la loro identificazione mediante l'analisi delle righe spettrali . Diversi tipi di spettri sono spesso utilizzati nella spettroscopia chimica , ad esempio IR , microonde , NMR , ESR , ecc. La spettroscopia viene anche utilizzata per identificare la composizione di oggetti remoti, come stelle e galassie lontane, analizzando i loro spettri di radiazione.

Il termine energia chimica viene spesso utilizzato per indicare la potenzialità di una sostanza chimica di subire una trasformazione attraverso una reazione chimica o di trasformare altre sostanze chimiche.
Reazione

Quando una sostanza chimica si trasforma in conseguenza della sua interazione con un'altra sostanza o con energia, si dice che si è verificata una reazione chimica. Una reazione chimica è quindi un concetto legato alla "reazione" di una sostanza quando viene a stretto contatto con un'altra, sia come miscela che come soluzione ; esposizione a qualche forma di energia, o entrambi. Si traduce in uno scambio di energia tra i costituenti della reazione e con l'ambiente del sistema, che può essere progettato come recipienti, spesso vetreria da laboratorio .
Le reazioni chimiche possono provocare la formazione o la dissociazione di molecole, cioè molecole che si separano per formare due o più molecole o riarrangiamento di atomi all'interno o attraverso le molecole. Le reazioni chimiche di solito comportano la creazione o la rottura di legami chimici. Ossidazione, riduzione , dissociazione , neutralizzazione acido-base e riarrangiamento molecolare sono alcuni dei tipi comunemente usati di reazioni chimiche.
Una reazione chimica può essere rappresentata simbolicamente attraverso un'equazione chimica . Mentre in una reazione chimica non nucleare il numero e il tipo di atomi su entrambi i lati dell'equazione sono uguali, per una reazione nucleare questo vale solo per le particelle nucleari, vale a dire. protoni e neutroni.
La sequenza di passaggi in cui può aver luogo la riorganizzazione dei legami chimici nel corso di una reazione chimica è chiamata meccanismo . Si può immaginare che una reazione chimica avvenga in più fasi, ognuna delle quali può avere una velocità diversa. Nel corso di una reazione possono quindi essere previsti molti intermedi di reazione con stabilità variabile. Vengono proposti meccanismi di reazione per spiegare la cinetica e il relativo mix di prodotti di una reazione. Molti chimici fisici sono specializzati nell'esplorazione e nel proporre i meccanismi di varie reazioni chimiche. Diverse regole empiriche, come le regole di Woodward-Hoffmann, spesso tornano utili mentre propongono un meccanismo per una reazione chimica.
Secondo il libro d'oro IUPAC , una reazione chimica è "un processo che porta all'interconversione di specie chimiche". Di conseguenza, una reazione chimica può essere una reazione elementare o una reazione graduale . Viene fatta un'ulteriore avvertenza, in quanto questa definizione include i casi in cui l' interconversione dei conformeri è osservabile sperimentalmente. Tali reazioni chimiche rilevabili normalmente coinvolgono insiemi di entità molecolari come indicato da questa definizione, ma è spesso concettualmente conveniente usare il termine anche per cambiamenti che coinvolgono singole entità molecolari (cioè 'eventi chimici microscopici').
Ioni e sali

Uno ione è una specie carica, un atomo o una molecola, che ha perso o guadagnato uno o più elettroni. Quando un atomo perde un elettrone e quindi ha più protoni che elettroni, l'atomo è uno ione o catione caricato positivamente . Quando un atomo guadagna un elettrone e quindi ha più elettroni che protoni, l'atomo è uno ione o un anione caricato negativamente . Cationi e anioni possono formare un reticolo cristallino di neutri sali , come ad esempio Na + e Cl - ioni formanti cloruro di sodio , o NaCl. Esempi di ioni poliatomici che non si scindono durante le reazioni acido-base sono l' idrossido (OH − ) e il fosfato (PO 4 3 − ).
Il plasma è composto da materia gassosa che è stata completamente ionizzata, solitamente ad alta temperatura.
Acidità e basicità

Una sostanza può essere spesso classificata come un acido o una base . Esistono diverse teorie che spiegano il comportamento acido-base. La più semplice è la teoria di Arrhenius , che afferma che l'acido è una sostanza che produce ioni idronio quando è disciolto in acqua, e una base è quella che produce ioni idrossido quando disciolta in acqua. Secondo la teoria acido-base di Brønsted-Lowry , gli acidi sono sostanze che donano uno ione idrogeno positivo a un'altra sostanza in una reazione chimica; per estensione, una base è la sostanza che riceve quello ione idrogeno.
Una terza teoria comune è la teoria acido-base di Lewis , che si basa sulla formazione di nuovi legami chimici. La teoria di Lewis spiega che un acido è una sostanza in grado di accettare una coppia di elettroni da un'altra sostanza durante il processo di formazione del legame, mentre una base è una sostanza che può fornire una coppia di elettroni per formare un nuovo legame. Secondo questa teoria, le cose cruciali che vengono scambiate sono le spese. Ci sono molti altri modi in cui una sostanza può essere classificata come un acido o una base, come è evidente nella storia di questo concetto.
La forza acida è comunemente misurata con due metodi. Una misura, basata sulla definizione di acidità di Arrhenius, è il pH , che è una misura della concentrazione di ioni idronio in una soluzione, espressa su una scala logaritmica negativa . Pertanto, le soluzioni che hanno un pH basso hanno un'alta concentrazione di ioni idronio e si può dire che siano più acide. L'altra misura, basata sulla definizione di Brønsted-Lowry, è la costante di dissociazione acida (K a ), che misura la capacità relativa di una sostanza di agire come un acido secondo la definizione di Brønsted-Lowry di un acido. Cioè, sostanze con una maggiore K una hanno maggiori probabilità di donare ioni idrogeno in reazioni chimiche rispetto a quelli con bassi K a valori.
Redox
Redox ( rosso uction- bue idation) reazioni comprendono tutte le reazioni chimiche in cui gli atomi hanno la loro stato di ossidazione modificato dalle elettroni guadagnando (riduzione) o elettroni perdere (ossidazione). Le sostanze che hanno la capacità di ossidare altre sostanze sono dette ossidanti e sono note come agenti ossidanti, ossidanti o ossidanti. Un ossidante rimuove gli elettroni da un'altra sostanza. Allo stesso modo, le sostanze che hanno la capacità di ridurre altre sostanze sono dette riducenti e sono note come agenti riducenti, riducenti o riducenti.
Un riducente trasferisce elettroni a un'altra sostanza e viene quindi ossidato a sua volta. E poiché "dona" elettroni è anche chiamato donatore di elettroni. L'ossidazione e la riduzione si riferiscono correttamente a un cambiamento nel numero di ossidazione: l'effettivo trasferimento di elettroni potrebbe non verificarsi mai. Pertanto, l'ossidazione è meglio definita come un aumento del numero di ossidazione e la riduzione come una diminuzione del numero di ossidazione.
Equilibrio
Sebbene il concetto di equilibrio sia ampiamente utilizzato in tutte le scienze, nel contesto della chimica, si presenta ogni volta che sono possibili diversi stati della composizione chimica, come ad esempio in una miscela di più composti chimici che possono reagire tra loro, o quando una sostanza può essere presente in più di un tipo di fase.
Un sistema di sostanze chimiche in equilibrio, pur avendo una composizione immutabile, il più delle volte non è statico ; le molecole delle sostanze continuano a reagire tra loro dando luogo ad un equilibrio dinamico . Il concetto descrive quindi lo stato in cui i parametri come la composizione chimica rimangono invariati nel tempo.
leggi chimiche
Le reazioni chimiche sono governate da determinate leggi, che sono diventate concetti fondamentali in chimica. Alcuni di loro sono:
- Legge di Avogadro
- Legge della birra-Lambert
- Legge di Boyle (1662, relativa pressione e volume)
- Legge di Carlo (1787, relativa a volume e temperatura)
- Le leggi di diffusione di Fick
- Legge di Gay-Lussac (1809, relativa pressione e temperatura)
- Il principio di Le Chatelier
- la legge di Henry
- legge di Hess
- La legge di conservazione dell'energia porta agli importanti concetti di equilibrio , termodinamica e cinetica .
- La legge di conservazione della massa continua a essere conservata nei sistemi isolati , anche nella fisica moderna. Tuttavia, la relatività speciale mostra che a causa dell'equivalenza massa-energia , ogni volta che l'"energia" non materiale (calore, luce, energia cinetica) viene rimossa da un sistema non isolato, una parte della massa andrà persa con esso. Perdite elevate di energia provocano la perdita di quantità pesabili di massa, un argomento importante nella chimica nucleare .
- Legge di composizione definita , sebbene in molti sistemi (in particolare biomacromolecole e minerali) i rapporti tendano a richiedere grandi numeri e siano frequentemente rappresentati come una frazione.
- Legge delle proporzioni multiple
- La legge di Raoult
Storia
La storia della chimica abbraccia un periodo che va dai tempi molto antichi ai giorni nostri. Da diversi millenni aC, le civiltà utilizzavano tecnologie che alla fine avrebbero costituito la base dei vari rami della chimica. Gli esempi includono l'estrazione di metalli dai minerali , la produzione di ceramiche e smalti, la fermentazione di birra e vino, l'estrazione di sostanze chimiche dalle piante per medicinali e profumi, la trasformazione del grasso in sapone , la produzione di vetro e la produzione di leghe come il bronzo . La chimica è stata preceduta dalla sua protoscienza, l' alchimia , che è un approccio intuitivo ma non scientifico alla comprensione dei costituenti della materia e delle loro interazioni. Non riuscì a spiegare la natura della materia e le sue trasformazioni, ma, eseguendo esperimenti e registrando i risultati, gli alchimisti posero le basi per la chimica moderna. La chimica come corpo di conoscenza distinto dall'alchimia iniziò ad emergere quando una chiara differenziazione fu fatta tra loro da Robert Boyle nella sua opera The Skeptical Chymist (1661). Mentre sia l'alchimia che la chimica si occupano della materia e delle sue trasformazioni, la differenza cruciale era data dal metodo scientifico che i chimici impiegavano nel loro lavoro. Si ritiene che la chimica sia diventata una scienza consolidata con il lavoro di Antoine Lavoisier , che sviluppò una legge di conservazione della massa che richiedeva un'attenta misurazione e osservazioni quantitative dei fenomeni chimici. La storia della chimica si intreccia con la storia della termodinamica , soprattutto attraverso il lavoro di Willard Gibbs .
Definizione
La definizione di chimica è cambiata nel tempo, poiché nuove scoperte e teorie si aggiungono alla funzionalità della scienza. Il termine "chimica", secondo il noto scienziato Robert Boyle nel 1661, indicava il soggetto dei principi materiali dei corpi misti. Nel 1663, il chimico Christopher Glaser descrisse la "chimica" come un'arte scientifica, mediante la quale si impara a dissolvere i corpi, e a trarre da essi le diverse sostanze sulla loro composizione, e come unirli nuovamente ed esaltarli a una perfezione superiore.
La definizione del 1730 della parola "chimica", come usata da Georg Ernst Stahl , indicava l'arte di risolvere corpi misti, composti o aggregati nei loro principi; e di comporre tali organismi a partire da tali principi. Nel 1837, Jean-Baptiste Dumas considerò la parola "chimica" per riferirsi alla scienza che si occupava delle leggi e degli effetti delle forze molecolari. Questa definizione si è ulteriormente evoluta fino a quando, nel 1947, è diventata la scienza delle sostanze: la loro struttura, le loro proprietà e le reazioni che le trasformano in altre sostanze – una caratterizzazione accettata da Linus Pauling . Più recentemente, nel 1998, il professor Raymond Chang ha ampliato la definizione di "chimica" per indicare lo studio della materia e dei cambiamenti che subisce.
Disciplina
Le prime civiltà, come gli egiziani, i babilonesi e gli indiani, accumularono conoscenze pratiche sulle arti della metallurgia, della ceramica e dei coloranti, ma non svilupparono una teoria sistematica.
Un'ipotesi chimica di base emerse per la prima volta nella Grecia classica con la teoria dei quattro elementi come proposta definitivamente da Aristotele affermando che fuoco , aria , terra e acqua erano gli elementi fondamentali da cui tutto è formato come combinazione. L' atomismo greco risale al 440 a.C., sorto in opere di filosofi come Democrito ed Epicuro . Nel 50 a.C., il filosofo romano Lucrezio espanse la teoria nel suo libro De rerum natura (Sulla natura delle cose). A differenza dei moderni concetti di scienza, l'atomismo greco era di natura puramente filosofica, con poca preoccupazione per le osservazioni empiriche e nessuna preoccupazione per gli esperimenti chimici.
Una prima forma dell'idea di conservazione della massa è la nozione che " Nulla viene dal nulla " nella filosofia greca antica , che si trova in Empedocle (circa IV secolo a.C.): "Perché è impossibile che qualcosa possa essere da ciò che non è, e non può essere determinato o sentito dire che ciò che è debba essere completamente distrutto". ed Epicuro (III secolo aC), il quale, descrivendo la natura dell'Universo, scrisse che "la totalità delle cose è sempre stata come è ora e sempre sarà".

Nel mondo ellenistico prolifica dapprima l'arte dell'alchimia, che mescola magia e occultismo allo studio delle sostanze naturali con il fine ultimo di trasmutare gli elementi in oro e scoprire l'elisir della vita eterna. Il lavoro, in particolare lo sviluppo della distillazione , continuò nel primo periodo bizantino con il praticante più famoso che fu il greco-egiziano Zosimo di Panopolis del IV secolo . L'alchimia continuò ad essere sviluppata e praticata in tutto il mondo arabo dopo le conquiste musulmane , e da lì, e dai resti bizantini, si diffuse nell'Europa medievale e rinascimentale attraverso traduzioni latine.
Lo sviluppo del metodo scientifico moderno fu lento e arduo, ma un primo metodo scientifico per la chimica iniziò ad emergere tra i primi chimici musulmani, a partire dal chimico perso-arabo del IX secolo Jābir ibn Hayyān , popolarmente noto come "il padre della chimica". Le opere arabe a lui attribuite introdussero una classificazione sistematica delle sostanze chimiche e fornirono istruzioni per derivare un composto inorganico ( sal ammoniacale o cloruro di ammonio ) da sostanze organiche (come piante, sangue e capelli) per via chimica. Alcune opere giabiriane arabe (ad esempio, il "Libro della Misericordia" e il "Libro dei Settanta") furono successivamente tradotte in latino con il nome latinizzato "Geber", e nell'Europa del XIII secolo uno scrittore anonimo, di solito indicato come pseudo -Geber , iniziò a produrre scritti alchemici e metallurgici sotto questo nome. Successivamente influenti filosofi musulmani, come Abū al-Rayhān al-Bīrūnī e Avicenna hanno contestato le teorie dell'alchimia, in particolare la teoria della trasmutazione dei metalli .
Sotto l'influenza dei nuovi metodi empirici proposti da Sir Francis Bacon e altri, un gruppo di chimici a Oxford , Robert Boyle , Robert Hooke e John Mayow iniziò a rimodellare le vecchie tradizioni alchemiche in una disciplina scientifica. Boyle in particolare è considerato il padre fondatore della chimica grazie alla sua opera più importante, il testo di chimica classico The Skeptical Chymist, in cui viene fatta la differenziazione tra le affermazioni dell'alchimia e le scoperte scientifiche empiriche della nuova chimica. Ha formulato la legge di Boyle , ha respinto i classici "quattro elementi" e ha proposto un'alternativa meccanicistica di atomi e reazioni chimiche che potrebbe essere soggetta a rigorosi esperimenti.

La teoria del flogisto (sostanza alla base di ogni combustione) fu proposta dal tedesco Georg Ernst Stahl all'inizio del XVIII secolo e fu ribaltata solo alla fine del secolo dal chimico francese Antoine Lavoisier , l'analogo chimico di Newton in fisica; che ha fatto più di ogni altro per fondare la nuova scienza su basi teoriche adeguate, chiarendo il principio di conservazione della massa e sviluppando un nuovo sistema di nomenclatura chimica usato fino ad oggi.
Prima del suo lavoro, tuttavia, erano state fatte molte scoperte importanti, in particolare relative alla natura dell'"aria", che si scoprì essere composta da molti gas diversi. Il chimico scozzese Joseph Black (il primo chimico sperimentale) e il fiammingo Jan Baptist van Helmont scoprirono l' anidride carbonica , o quella che Black chiamava "aria fissa" nel 1754; Henry Cavendish scoprì l' idrogeno e ne spiegò le proprietà e Joseph Priestley e, indipendentemente, Carl Wilhelm Scheele, isolarono l' ossigeno puro .
Lo scienziato inglese John Dalton propose la moderna teoria degli atomi ; che tutte le sostanze sono composte da "atomi" indivisibili di materia e che atomi diversi hanno pesi atomici variabili.
Lo sviluppo della teoria elettrochimica delle combinazioni chimiche avvenne all'inizio del XIX secolo grazie al lavoro di due scienziati in particolare, Jöns Jacob Berzelius e Humphry Davy , reso possibile dalla precedente invenzione della pila voltaica di Alessandro Volta . Davy ha scoperto nove nuovi elementi, inclusi i metalli alcalini, estraendoli dai loro ossidi con corrente elettrica.

Il britannico William Prout propose per primo di ordinare tutti gli elementi in base al loro peso atomico poiché tutti gli atomi avevano un peso che era un multiplo esatto del peso atomico dell'idrogeno. JAR Newlands ha ideato una prima tavola degli elementi, che è stata poi sviluppata nella moderna tavola periodica degli elementi nel 1860 da Dmitri Mendeleev e indipendentemente da molti altri scienziati tra cui Julius Lothar Meyer . I gas inerti, in seguito chiamati gas nobili, furono scoperti da William Ramsay in collaborazione con Lord Rayleigh alla fine del secolo, completando così la struttura di base della tavola.

In basso: risultati osservati: una piccola porzione delle particelle è stata deviata, indicando una piccola carica concentrata .
All'inizio del ventesimo secolo i fondamenti teorici della chimica furono finalmente compresi grazie a una serie di notevoli scoperte che riuscirono a sondare e scoprire la natura stessa della struttura interna degli atomi. Nel 1897, JJ Thomson dell'Università di Cambridge scoprì l' elettrone e poco dopo lo scienziato francese Becquerel e la coppia Pierre e Marie Curie studiarono il fenomeno della radioattività . In una serie di esperimenti di diffusione pionieri Ernest Rutherford presso l' Università di Manchester scoperto la struttura interna dell'atomo e l'esistenza del protone, classificato e spiegato i diversi tipi di radioattività e con successo trasmutato il primo elemento bombardando azoto con particelle alfa .
Il suo lavoro sulla struttura atomica è stato migliorato dai suoi studenti, il fisico danese Niels Bohr e Henry Moseley . La teoria elettronica dei legami chimici e degli orbitali molecolari è stata sviluppata dagli scienziati americani Linus Pauling e Gilbert N. Lewis .
Il 2011 è stato dichiarato dalle Nazioni Unite Anno Internazionale della Chimica. È stata un'iniziativa dell'Unione internazionale di chimica pura e applicata e dell'Organizzazione delle Nazioni Unite per l'educazione, la scienza e la cultura e coinvolge società chimiche, accademici e istituzioni in tutto il mondo e si è basata su iniziative individuali per organizzare attività locali e regionali.
La chimica organica fu sviluppata da Justus von Liebig e altri, seguendo la sintesi dell'urea di Friedrich Wöhler che dimostrò che gli organismi viventi erano, in teoria, riducibili alla chimica. Altri progressi cruciali del XIX secolo furono; una comprensione del legame di valenza ( Edward Frankland nel 1852) e l'applicazione della termodinamica alla chimica ( JW Gibbs e Svante Arrhenius nel 1870).
Pratica
sottodiscipline
La chimica è tipicamente suddivisa in diverse principali sotto-discipline. Ci sono anche diversi principali campi interdisciplinari e più specializzati della chimica.
- La chimica analitica è l'analisi di campioni di materiale per ottenere una comprensione della loro composizione e struttura chimica . La chimica analitica incorpora metodi sperimentali standardizzati in chimica. Questi metodi possono essere utilizzati in tutte le sottodiscipline della chimica, esclusa la chimica puramente teorica.
- La biochimica è lo studio delle sostanze chimiche , delle reazioni chimiche e delle interazioni chimiche che avvengono negli organismi viventi . La biochimica e la chimica organica sono strettamente correlate, come nella chimica medicinale o nella neurochimica . La biochimica è anche associata alla biologia molecolare e alla genetica .
- La chimica inorganica è lo studio delle proprietà e delle reazioni dei composti inorganici. La distinzione tra discipline organiche e inorganiche non è assoluta e c'è molta sovrapposizione, soprattutto nella sotto-disciplina della chimica organometallica .
- La chimica dei materiali è la preparazione, la caratterizzazione e la comprensione di sostanze con una funzione utile. Il campo è una nuova ampiezza di studio nei programmi di laurea e integra elementi di tutte le aree classiche della chimica con un focus su questioni fondamentali che sono uniche per i materiali. I principali sistemi di studio includono la chimica delle fasi condensate (solidi, liquidi, polimeri ) e le interfacce tra le diverse fasi.
- La neurochimica è lo studio delle sostanze neurochimiche ; compresi trasmettitori, peptidi, proteine, lipidi, zuccheri e acidi nucleici; le loro interazioni e i ruoli che svolgono nella formazione, nel mantenimento e nella modifica del sistema nervoso.
- La chimica nucleare è lo studio di come le particelle subatomiche si uniscono e formano i nuclei. La moderna trasmutazione è una grande componente della chimica nucleare e la tabella dei nuclidi è un risultato e uno strumento importante per questo campo.
- La chimica organica è lo studio della struttura, delle proprietà, della composizione, dei meccanismi e delle reazioni dei composti organici . Un composto organico è definito come qualsiasi composto basato su uno scheletro di carbonio.
- La chimica fisica è lo studio delle basi fisiche e fondamentali dei sistemi e dei processi chimici. In particolare, l'energia e la dinamica di tali sistemi e processi sono di interesse per i chimici fisici. Importanti aree di studio includono la termodinamica chimica , la cinetica chimica , l' elettrochimica , la meccanica statistica , la spettroscopia e, più recentemente, l' astrochimica . La chimica fisica ha un'ampia sovrapposizione con la fisica molecolare . La chimica fisica implica l'uso del calcolo infinitesimale nella derivazione di equazioni. Di solito è associato alla chimica quantistica e alla chimica teorica. La chimica fisica è una disciplina distinta dalla fisica chimica , ma ancora una volta c'è una forte sovrapposizione.
- La chimica teorica è lo studio della chimica attraverso il ragionamento teorico fondamentale (di solito all'interno della matematica o della fisica ). In particolare l'applicazione della meccanica quantistica alla chimica è chiamata chimica quantistica . Dalla fine della seconda guerra mondiale , lo sviluppo dei computer ha permesso uno sviluppo sistematico della chimica computazionale , che è l'arte di sviluppare e applicare programmi per computer per risolvere problemi chimici. La chimica teorica ha un'ampia sovrapposizione con la fisica della materia condensata (teorica e sperimentale) e la fisica molecolare .
Altre discipline all'interno della chimica sono tradizionalmente raggruppate in base al tipo di materia studiata o al tipo di studio. Questi includono la chimica inorganica , lo studio della materia inorganica ; chimica organica , lo studio della materia organica (a base di carbonio); biochimica , lo studio delle sostanze presenti negli organismi biologici ; chimica fisica , lo studio dei processi chimici utilizzando concetti fisici come la termodinamica e la meccanica quantistica ; e chimica analitica , l'analisi di campioni di materiale per ottenere una comprensione della loro composizione chimica e struttura . Negli ultimi anni sono emerse molte discipline più specializzate, ad esempio la neurochimica, lo studio chimico del sistema nervoso (vedi sottodiscipline ).
Altri campi includono agrochimica , astrochimica (e cosmochimica ), chimica dell'atmosfera , ingegneria chimica , biologia chimica , chemioinformatica , elettrochimica , chimica ambientale , femtochimica , chimica degli aromi , chimica del flusso , geochimica , chimica verde , istochimica , storia della chimica , chimica dell'idrogenazione , immunochimica , chimica marina , scienza dei materiali , chimica matematica , meccanochimica , chimica medicinale , biologia molecolare , meccanica molecolare , nanotecnologia , chimica dei prodotti naturali , enologia , chimica organometallica , petrolchimica , farmacologia , fotochimica , chimica organica fisica , fitochimica , chimica dei polimeri , radiochimica , chimica dello stato solido , sonochimica , chimica supramolecolare , chimica di superficie , chimica sintetica , termochimica e molti altri.
Industria
L' industria chimica rappresenta un'importante attività economica a livello mondiale. I primi 50 produttori di sostanze chimiche a livello mondiale nel 2013 ha avuto un fatturato di US $ 980,5 miliardi, con un margine di profitto del 10,3%.
Società professionali
- Società Chimica Americana
- Società americana di neurochimica
- Istituto Chimico del Canada
- Società Chimica del Perù
- Unione Internazionale di chimica pura e applicata
- Istituto chimico reale australiano
- Società Chimica Reale Olandese
- Società Reale di Chimica
- Società dell'Industria Chimica
- Associazione Mondiale dei Chimici Teorici e Computazionali
- Elenco delle società chimiche
Guarda anche
- Confronto di software per la modellazione della meccanica molecolare
- Glossario dei termini della chimica
- Anno Internazionale della Chimica
- Elenco dei chimici
- Elenco dei composti
- Elenco delle pubblicazioni importanti in chimica
- Elenco dei problemi irrisolti in chimica
- Cenni di chimica
- Sistemi periodici di piccole molecole
- Filosofia della chimica
- Turismo scientifico
Riferimenti
Bibliografia
- Atkins, Pietro ; de Paula, Julio (2009) [1992]. Elementi di chimica fisica (5a ed.). New York: Pressa dell'università di Oxford . ISBN 978-0-19-922672-6.
- Burrows, Andrew; Holman, Giovanni; Parsons, Andrew; Pilling, Gwen; Prezzo, Gareth (2009). Chimica 3 . Italia: Pressa dell'università di Oxford . ISBN 978-0-19-927789-6.
- Housecroft, Catherine E.; Sharpe, Alan G. (2008) [2001]. Chimica Inorganica (3a ed.). Harlow, Essex: Istruzione Pearson . ISBN 978-0-13-175553-6.
Ulteriori letture
- Lettura popolare
- Atkins, PW Galileo's Finger ( Oxford University Press ) ISBN 0-19-860941-8
- Atkins, PW Atkins' Molecules (Cambridge University Press) ISBN 0-521-82397-8
- Kean, Sam. The Disappearing Spoon - e altri racconti veri dalla tavola periodica (Black Swan) Londra, 2010 ISBN 978-0-552-77750-6
- Levi, Primo La tavola periodica (Penguin Books) [1975] tradotto dall'italiano da Raymond Rosenthal (1984) ISBN 978-0-14-139944-7
- Stwertka, A. Una guida agli elementi (Oxford University Press) ISBN 0-19-515027-9
- "Dizionario della Storia delle Idee" . Archiviato dall'originale il 10 marzo 2008.
- . Enciclopedia Britannica . 6 (11a ed.). 1911. pp. 33-76.
- Libri di testo introduttivi per la laurea
- Atkins, PW, Overton, T., Rourke, J., Weller, M. e Armstrong, F. Shriver e Atkins chimica inorganica (4a edizione) 2006 (Oxford University Press) ISBN 0-19-926463-5
- Chang, Raimondo. Chimica 6a ed. Boston: James M. Smith, 1998. ISBN 0-07-115221-0 .
- Clayden, Jonathan ; Greves, Nick; Warren, Stuart ; Wothers, Peter (2001). Chimica Organica (1a ed.). La stampa dell'università di Oxford. ISBN 978-0-19-850346-0.
- Voet e Voet Biochimica (Wiley) ISBN 0-471-58651-X
- Libri di testo di livello universitario avanzato o di laurea
- Atkins, PW Physical Chemistry (Oxford University Press) ISBN 0-19-879285-9
- Atkins, PW et al. Meccanica quantistica molecolare (Oxford University Press)
- McWeeny, Valence di R. Coulson (Oxford Science Publications) ISBN 0-19-855144-4
- Pauling, L. La natura del legame chimico (Cornell University Press) ISBN 0-8014-0333-2
- Pauling, L. e Wilson, EB Introduzione alla meccanica quantistica con applicazioni alla chimica (pubblicazioni di Dover) ISBN 0-486-64871-0
- Smart and Moore Solid State Chemistry: An Introduction (Chapman e Hall) ISBN 0-412-40040-5
- Stephenson, G. Metodi matematici per studenti di scienze (Longman) ISBN 0-582-44416-0







