Doppio legame - Double bond
In chimica, un doppio legame è un legame covalente tra due atomi che coinvolge quattro elettroni di legame anziché due in un singolo legame . I doppi legami si verificano più comunemente tra due atomi di carbonio, ad esempio negli alcheni . Esistono molti doppi legami tra due elementi diversi: per esempio, in un gruppo carbonilico tra un atomo di carbonio e un atomo di ossigeno. Altri doppi legami comuni si trovano negli azocomposti (N=N), nelle immine (C=N) e nei solfossidi (S=O). In una formula scheletrica , un doppio legame è disegnato come due linee parallele (=) tra i due atomi collegati; tipograficamente, viene utilizzato il segno di uguale . I doppi legami furono introdotti per la prima volta nella notazione chimica dal chimico russo Alexander Butlerov .
I doppi legami che coinvolgono il carbonio sono più forti e più corti dei legami singoli . L' ordine delle obbligazioni è due. I doppi legami sono anche ricchi di elettroni, il che li rende potenzialmente più reattivi in presenza di un forte accettore di elettroni (come anche le reazioni degli alogeni).
- Composti chimici con doppi legami
Doppio legame etilene carbonio-carbonio
Acetone Doppio legame carbonio-ossigeno
Dimetilsolfossido Doppio legame zolfo-ossigeno
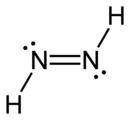
Diazene Doppio legame azoto-azoto
Doppi legami negli alcheni
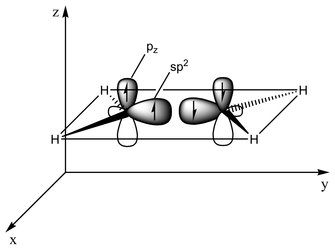
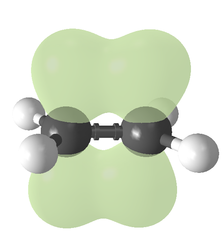
Il tipo di legame può essere spiegato in termini di ibridazione orbitale . In etilene ogni atomo di carbonio ha tre sp 2 orbitali e una p-orbitale . I tre orbitali sp 2 giacciono su un piano con angoli di ~120°. L'orbitale p è perpendicolare a questo piano. Quando gli atomi di carbonio si avvicinano, due degli orbitali sp 2 si sovrappongono per formare un legame sigma . Allo stesso tempo, i due orbitali p si avvicinano (di nuovo sullo stesso piano) e insieme formano un legame pi greco . Per la massima sovrapposizione, gli orbitali p devono rimanere paralleli e, quindi, la rotazione attorno al legame centrale non è possibile. Questa proprietà dà origine all'isomerismo cis-trans . I doppi legami sono più corti dei singoli legami perché la sovrapposizione p-orbitale è massimizzata.
Con 133 pm, la lunghezza del legame C=C dell'etilene è più corta della lunghezza C-C dell'etano con 154 pm. Il doppio legame è anche più forte, 636 kJ mol -1 rispetto a 368 kJ mol -1 ma non il doppio di quanto il legame pi sia più debole del legame sigma a causa della sovrapposizione pi meno efficace.
In una rappresentazione alternativa, il doppio legame risulta da due orbitali sp 3 sovrapposti come in un legame piegato .
Variazioni
Nelle molecole con doppi legami alternati e legami singoli, la sovrapposizione p-orbitale può esistere su più atomi in una catena, dando origine a un sistema coniugato . La coniugazione può essere trovata in sistemi come dieni ed enoni . Nelle molecole cicliche , la coniugazione può portare all'aromaticità . Nei cumuleni , due doppi legami sono adiacenti.
I doppi legami sono comuni per gli elementi di periodo 2 carbonio , azoto e ossigeno , e meno comuni con elementi di periodi più alti . Anche i metalli possono impegnarsi in legami multipli in un legame multiplo con legante metallico .
Gruppo 14 alcheni omologhi
Composti a doppio legame, omologhi degli alcheni , R 2 E=ER 2 sono ora noti per tutti gli elementi più pesanti del gruppo 14 . A differenza degli alcheni questi composti non sono planari ma adottano strutture ritorte e/o transpiegate. Questi effetti diventano più pronunciati per gli elementi più pesanti. Il distannene (Me 3 Si) 2 CHSn=SnCH(SiMe 3 ) 2 ha una lunghezza del legame stagno-stagno appena un po' più corta di un singolo legame, una struttura curvata trans con coordinazione piramidale ad ogni atomo di stagno e si dissocia facilmente in soluzione a forma (Me 3 Si) 2 CHSn: (stannandiile, un analogo del carbene). Il legame comprende due deboli legami donatori accettori, la coppia solitaria su ciascun atomo di stagno che si sovrappone all'orbitale p vuoto sull'altro. Al contrario, nei disileni ogni atomo di silicio ha coordinazione planare ma i sostituenti sono attorcigliati in modo che la molecola nel suo insieme non sia planare. Nei diplumbeni la lunghezza del legame Pb=Pb può essere maggiore di quella di molti corrispondenti singoli legami Plumbeni e stanneni generalmente si dissociano in soluzione in monomeri con entalpie di legame che sono solo una frazione dei corrispondenti singoli legami. Alcuni doppi legami plumbeni e stanneni sono simili in forza ai legami idrogeno. Il modello di Carter-Goddard-Malrieu-Trinquier può essere utilizzato per prevedere la natura del legame.
Tipi di doppi legami tra atomi
| C | oh | no | S | si | Ge | Sn | Pb | |
|---|---|---|---|---|---|---|---|---|
| C | alchene | gruppo carbonilico | immine | tiochetone , tial | ||||
| oh | diossigeno | composto nitroso | solfossido , solfone , acido solfinico , acido solfonico | |||||
| no | composto azoico | |||||||
| S | disolfuro | |||||||
| si | alchilidenilani | silene | ||||||
| Ge | germeni | |||||||
| Sn | stanneni | |||||||
| Pb | plumbes |
Riferimenti
- Pyykkö, Pekka; Riedel, Sebastiano; Patzschke, Michael (2005). "Raggi covalenti a triplo legame". Chimica: un giornale europeo . 11 (12): 3511-20. doi : 10.1002/chem.200401299 . PMID 15832398 .