Flavoproteina deidrogenasi a trasferimento di elettroni - Electron-transferring-flavoprotein dehydrogenase
| Flavoproteina deidrogenasi a trasferimento di elettroni | |||||||
|---|---|---|---|---|---|---|---|
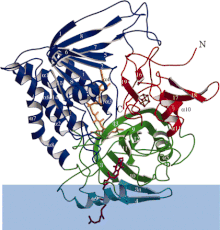 Diagramma a nastro della flavoproteina deidrogenasi che trasferisce gli elettroni con ciascun dominio funzionale colorato in modo differenziale. La banda blu è l'area della membrana.
| |||||||
| Identificatori | |||||||
| Simbolo | ETFD | ||||||
| Alt. simboli | ETF-QO | ||||||
| gene NCBI | 2110 | ||||||
| HGNC | 3483 | ||||||
| OMIM | 231675 | ||||||
| PDB | 2GMH | ||||||
| SeqRif | NM_004453 | ||||||
| UniProt | Q16134 | ||||||
| Altri dati | |||||||
| numero CE | 1.5.5.1 | ||||||
| luogo | Cr. 4 q4q32.1 | ||||||
| |||||||
La flavoproteina deidrogenasi a trasferimento di elettroni ( ETF deidrogenasi o flavoproteina a trasferimento di elettroni-ubichinone ossidoreduttasi , EC 1.5.5.1 ) è un enzima che trasferisce gli elettroni dalla flavoproteina a trasferimento di elettroni nella matrice mitocondriale , al pool di ubichinone nella membrana mitocondriale interna . Fa parte della catena di trasporto degli elettroni . L'enzima si trova sia nei procarioti che negli eucarioti e contiene un cluster di flavina e FE-S . Nell'uomo è codificato dal gene ETFDH . La carenza di ETF deidrogenasi causa la malattia genetica umana carenza multipla di acil-CoA deidrogenasi .
Funzione
ETQ-QO collega l'ossidazione degli acidi grassi e di alcuni amminoacidi alla fosforilazione ossidativa nei mitocondri. Nello specifico, catalizza il trasferimento di elettroni dalla flavoproteina di trasferimento di elettroni (ETF) all'ubichinone, riducendolo ad ubiquinolo. L'intera sequenza delle reazioni di trasferimento è la seguente:
Acil-CoA → Acil-CoA deidrogenasi → ETF → ETF-QO → UQ → Complesso III .
Reazione catalizzata
La reazione complessiva catalizzata da ETF-QO è la seguente:
ETF-QO(rosso) + ubichinone ↔ ETF-QO(ox) + ubichinolo
L'attività enzimatica viene solitamente valutata spettrofotometricamente mediante reazione con ottanoil-CoA come donatore di elettroni e ubichinone-1 come accettore di elettroni. L'enzima può anche essere dosato tramite la sproporzione del semichinone ETF. Entrambe le reazioni sono di seguito:
Ottanoil-CoA + Q 1 ↔ Q 1 H 2 + Oct-2-enoil-CoA
2 ETF 1- ↔ ETF bue + ETF 2-
Struttura
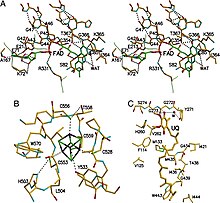
ETF-QO consiste in un dominio strutturale con tre domini funzionali impacchettati nelle immediate vicinanze: un dominio FAD, un dominio cluster 4Fe4S e un dominio UQ-binding. Il FAD è in una conformazione estesa ed è sepolto profondamente all'interno del suo dominio funzionale. Più legami idrogeno e un dipolo elicoidale positivo modulano il potenziale redox di FAD e possono eventualmente stabilizzare l' intermedio semichinone anionico . Il cluster 4Fe4S è anche stabilizzato da estesi legami a idrogeno attorno al cluster e ai suoi componenti di cisteina . Il legame dell'ubichinone si ottiene attraverso una profonda tasca di legame idrofoba che è una modalità diversa rispetto ad altre proteine che legano l'UQ come la succinato-Q ossidoreduttasi . Sebbene l'ETF-QO sia una proteina integrale di membrana, non attraversa l'intera membrana a differenza di altre proteine che legano l'UQ.
Meccanismo
L'esatto meccanismo per la riduzione è sconosciuto, sebbene ci siano due percorsi ipotizzati. La prima via è il trasferimento di elettroni da un ETF ridotto di un elettrone uno alla volta al centro FAD a potenziale inferiore. Un elettrone viene trasferito dal FAD ridotto al cluster di ferro, risultando in uno stato ridotto di due elettroni con un elettrone ciascuno sui domini FAD e cluster. Quindi, l'ubichinone legato viene ridotto ad ubichinolo, formando almeno transitoriamente il semiubichinone singolarmente ridotto. La seconda via prevede la donazione di elettroni dall'ETF al cluster di ferro, seguita da transizioni interne tra i due centri di elettroni. Dopo l'equilibrio, il resto del percorso segue come sopra.
Significato clinico
La carenza di ETF-QO provoca un disturbo noto come acidemia glutarica di tipo II (noto anche come MADD per il deficit multiplo di acil-CoA deidrogenasi), in cui vi è un accumulo improprio di grassi e proteine nel corpo. Le complicanze possono comportare acidosi o ipoglicemia , con altri sintomi come debolezza generale, ingrossamento del fegato, aumento dell'insufficienza cardiaca e carenza di carnitina . I casi più gravi riguardano difetti congeniti e crisi metaboliche complete. Dal punto di vista genetico, è una malattia autosomica recessiva, il che rende la sua comparsa abbastanza rara. La maggior parte dei pazienti affetti sono il risultato di mutazioni puntiformi intorno all'interfaccia ubichinone FAD. Le forme più lievi del disturbo hanno risposto alla terapia con riboflavina e sono state coniate MADD sensibili alla riboflavina (RR-MADD), sebbene a causa delle diverse mutazioni che causano il trattamento della malattia e i sintomi possano variare considerevolmente.