Protoporfiria eritropoietica - Erythropoietic protoporphyria
| Protoporfiria eritropoietica | |
|---|---|
| Altri nomi | EPP |
 | |
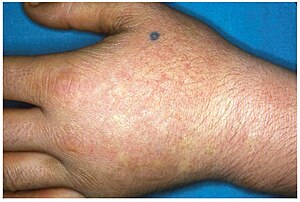
| Lesioni cutanee croniche di EPP | |
| Specialità |
Endocrinologia , dermatologia |
| Fattori di rischio | dolore e irritazione |
La protoporfiria eritropoietica (o comunemente chiamata EPP) è una forma di porfiria , che varia in gravità e può essere molto dolorosa. Deriva da una carenza dell'enzima ferrochelatasi , che porta a livelli anormalmente alti di protoporfirina nei globuli rossi (eritrociti) , nel plasma, nella pelle e nel fegato . La gravità varia in modo significativo da individuo a individuo.
Una forma clinicamente simile di porfiria, nota come protoporfiria dominante legata all'X, è stata identificata nel 2008.
Presentazione
L'EPP di solito si presenta nell'infanzia con la modalità di presentazione più comune come fotosensibilità acuta della pelle. Colpisce le aree esposte al sole e tende ad essere intrattabile. Pochi minuti di esposizione al sole provocano prurito, eritema, gonfiore e dolore. Periodi di esposizione più lunghi possono provocare ustioni di secondo grado. Dopo un'esposizione ripetitiva, i pazienti possono presentare lichenificazione, ipopigmentazione, iperpigmentazione e cicatrici della pelle.
L'EPP di solito si manifesta per la prima volta durante l'infanzia e il più delle volte colpisce il viso e le superfici superiori di braccia, mani e piedi e le superfici esposte delle gambe. La maggior parte dei pazienti, se l'EPP non è così grave, manifesta sintomi con l'inizio della pubertà quando i livelli ormonali maschili e femminili aumentano durante lo sviluppo sessuale e il mantenimento. L'EPP più grave può manifestarsi nell'infanzia. L'EPP può essere attivato tramite l'esposizione al sole anche se il paziente si trova dietro un vetro. È noto che anche le emissioni UV della saldatura ad arco con l'uso della maschera protettiva completa innescano l'EPP. L'EPP può manifestarsi anche tra i 3 ei 6 anni.
L'esposizione prolungata al sole può causare edema a mani, viso e piedi, raramente con vesciche e petecchie. Talvolta può verificarsi un ispessimento della pelle.
Le persone con EPP sono anche a maggior rischio di sviluppare calcoli biliari . Uno studio ha rilevato che i pazienti con EPP soffrono di carenza di vitamina D.
Insufficienza epatica
La protoporfirina si accumula a livelli tossici nel fegato nel 5-20% dei pazienti con EPP, portando a insufficienza epatica. Lo spettro delle malattie epatobiliari associate all'EPP è ampio. Comprende colelitiasi, malattia epatica parenchimale lieve, malattia epatocellulare progressiva e malattia epatica allo stadio terminale.
La mancanza di marcatori diagnostici per l'insufficienza epatica rende difficile prevedere quali pazienti potrebbero manifestare insufficienza epatica e il meccanismo dell'insufficienza epatica è scarsamente compreso. Uno studio retrospettivo europeo ha identificato 31 pazienti con EPP che hanno ricevuto un trapianto di fegato tra il 1983 e il 2008, con reazioni fototossiche nel 25% dei pazienti che non erano protetti dai filtri luminosi chirurgici. Lo stesso studio ha rilevato una recidiva del 69% della malattia nell'organo innestato. Cinque trapianti di fegato nel Regno Unito per EPP sono stati identificati tra il 1987 e il 2009. Si raccomandano frequenti test del fegato nei pazienti con EPP per i quali non è stata identificata alcuna terapia efficace per gestire l'insufficienza epatica.
Gravidanza
È stato segnalato che i sintomi di fotosensibilità EPP diminuiscono in alcune pazienti di sesso femminile durante la gravidanza e le mestruazioni, sebbene questo fenomeno non sia coerente e il meccanismo non sia compreso.
Genetica
La maggior parte dei casi di EPP sono risultati di errori congeniti del metabolismo, ma il difetto metabolico in alcuni pazienti può essere acquisito. La mutazione del gene che codifica per la ferrochelatasi nel braccio lungo del cromosoma 18 si trova nella maggior parte dei casi. La ferrochelatasi (FECH) catalizza l'inserimento del ferro ferroso nell'anello della protoporfirina IX per formare l'eme. L'EPP mostra modelli di ereditarietà sia recessivi che dominanti e un alto grado di eterogeneità allelica con penetranza incompleta. La maggior parte degli eterozigoti è asintomatica. I sintomi non si verificano a meno che l'attività FECH non sia inferiore al 30% del normale, ma livelli così bassi non sono presenti nella maggior parte dei pazienti.
Fisiopatologia
Le cellule che sintetizzano l'eme sono prevalentemente eritroblasti / reticolociti nel midollo osseo (80%) ed epatociti (20%). La carenza di FECH determina un aumento del rilascio di protoporfirina, che si lega all'albumina nel plasma e successivamente subisce l'estrazione epatica. Normalmente, la maggior parte della protoporfirina negli epatociti viene secreta nella bile; il resto subisce la trasformazione in eme. Una parte della protoporfirina nella bile viene restituita al fegato come conseguenza della circolazione enteroepatica; la restante protoporfirina nell'intestino subisce l'escrezione fecale. La protoporfirina è insolubile e quindi non disponibile per l'escrezione renale. Nell'EPP, la biotrasformazione subnormale della protoporfirina in eme determina un accumulo di protoporfirina negli epatociti.
Poiché il deficit di FECH è associato ad un aumento delle concentrazioni di protoporfirina negli eritrociti, nel plasma, nella pelle e nel fegato, la ritenzione di protoporfirina nella pelle predispone alla fotosensibilità acuta. Come risultato dell'assorbimento della luce ultravioletta e visibile (sensibilità di picco a 400 nm, con picchi minori tra 500-625 nm) da parte della protoporfirina nel plasma e negli eritrociti quando il sangue circola attraverso i vasi dermici, si formano radicali liberi, gli eritrociti diventano instabili e lesioni alla pelle è indotto.
Un significativo aumento dell'escrezione epatobiliare di protoporfirina può danneggiare il fegato sia attraverso fenomeni colestatici che stress ossidativo, predisponendo a malattie epatobiliari di vari gradi di gravità
Diagnosi
L'EPP è generalmente sospettata dalla presenza di fotosensibilità acuta della pelle e può essere confermata dalla rilevazione di un picco di fluorescenza plasmatica a 634 nm. È anche utile trovare livelli aumentati di protoporfirina nelle feci e la dimostrazione di un eccesso di protoporfirina libera negli eritrociti.
Lo screening per la mutazione FECH su un allele o la mutazione con guadagno di funzione dell'acido aminolevulinico sintasi 2 in membri selezionati della famiglia può essere utile, specialmente nella consulenza genetica.
La biopsia epatica conferma la malattia epatica nell'EPP per la presenza di depositi di protoporfirina negli epatociti che possono essere osservati come pigmento marrone all'interno dei canalicoli biliari e dei macrofagi portali. Macroscopicamente, il fegato cirrotico può avere un colore nero a causa dei depositi di protoporfirina. Utilizzando la luce polarizzata si trova la caratteristica forma a croce maltese dei depositi di pigmento cristallino birifrangenti. L'esame del tessuto epatico sotto una lampada di Wood rivela una fluorescenza rossa dovuta alla protoporfirina. La biopsia epatica non è utile per la stima della prognosi della malattia epatica.
Trattamento
Non esiste una cura per questo disturbo; tuttavia, i sintomi di solito possono essere gestiti limitando l'esposizione al sole diurno e ad alcuni tipi di illuminazione artificiale. La maggior parte dei tipi di illuminazione artificiale emette luce nelle lunghezze d'onda problematiche, con l'illuminazione fluorescente che è il peggior colpevole. La temperatura del colore può essere un buon indicatore di quale luce è più dannosa, poiché maggiore è la temperatura del colore, maggiore è la luce viola (380-450 nm) emessa. L'illuminazione a incandescenza e LED nella gamma bianca morbida (2700-3000K) produce la luce meno problematica. Inoltre, la selezione di lampadine di potenza inferiore può ridurre l'emissione complessiva di luce.
Poiché la fotosensibilità deriva dalla luce nello spettro visibile, la maggior parte dei filtri solari è di scarsa utilità (ad eccezione dell'ossido di zinco non nano che fornisce una protezione uniforme tra 290-400 nm e una certa protezione fino a 700 nm). Anche gli indumenti protettivi dal sole possono essere molto utili, sebbene gli indumenti con valori UPF siano valutati solo in base alla loro protezione UV (fino a 400 nm) e non in base alla loro protezione dallo spettro visibile. Alcuni produttori di indumenti protettivi solari utilizzano ossido di zinco nei loro tessuti, come la linea ZnO Suntect di Coolibar, che offrirà protezione dalla luce visibile.
Alcuni pazienti costruiscono gradualmente uno strato protettivo di melanina esponendosi regolarmente per brevi periodi alle radiazioni ultraviolette.
Le pellicole per vetri che bloccano i raggi UV e la luce visibile fino a 450 nm possono fornire sollievo dai sintomi se applicate ai finestrini dell'auto e della casa del paziente. Un esempio di tale potrebbe essere Madico Amber 81 che può proteggere attraverso la gamma di 500 nm.
I proteggi schermo blu possono aiutare a fornire sollievo dai sintomi causati da televisori, telefoni, tablet e schermi di computer.
L'EPP è considerata una delle porfirie meno gravi. A meno che non vi sia insufficienza epatica, non è una malattia pericolosa per la vita.
Terapie approvate
L'afamelanotide , sviluppato dalla Clinuvel Pharmaceuticals con sede in Australia, è stato approvato in Europa nel dicembre 2014 per il trattamento o la prevenzione della fototossicità negli adulti con EPP.
Uso off-label
Diversi farmaci vengono utilizzati off-label da pazienti con EPP:
- L'acido ursodesossicolico è un acido biliare che viene somministrato per promuovere la secrezione biliare di protoporfirina. I risultati del suo utilizzo nell'EPP sono controversi. Tuttavia, è noto per alterare la composizione della bile, per proteggere gli epatociti dall'effetto citotossico degli acidi biliari idrofobici e per stimolare la secrezione biliare mediante diversi meccanismi distinti.
- L'ematina sembra ridurre la produzione di protoporfirina in eccesso nel midollo osseo. È stato somministrato a pazienti con EPP (3-4 mg / kg iv) che sviluppano una crisi dopo il trapianto di fegato.
- La plasmaferesi può anche ridurre i livelli di protoporfirina nel plasma, tuttavia il suo utilizzo nel trattamento degli episodi acuti è controverso.
- La colestiramina è una resina somministrata per via orale che riduce i livelli circolanti di protoporfirina legandosi alla protoporfirina nell'intestino e, quindi, interrompendo la circolazione enteroepatica. Di solito è usato in combinazione con altri approcci terapeutici.
- Il carbone attivo , come la colestiramina, si lega alla protoporfirina nell'intestino e ne impedisce l'assorbimento. È economico e facilmente reperibile. Sembra essere efficace nel ridurre i livelli circolanti di protoporfirina.
Il trapianto di midollo osseo , il trapianto di fegato , l' acetilcisteina , la dialisi extracorporea con albumina , il ferro parenterale e la trasfusione di eritrociti sono piani alternativi per il trattamento dell'EEP.
Supplementi OTC
Alcuni integratori da banco possono aiutare:
- Proferrin è un integratore di eme orale che può funzionare in modo simile all'ematina.
- B. subtilis (un probiotico del suolo gram-positivo) produce ferrochelatasi, che può essere in grado di convertire parte della protoporfirina nell'intestino in eme.
- Beta carotene , anche se una recente meta analisi del trattamento con carotene ha messo in dubbio la sua efficacia.
Epidemiologia
I case report suggeriscono che l'EPP è prevalente a livello globale. La prevalenza è stata stimata tra 1 su 75.000 e 1 su 200.000, tuttavia è stato notato che la prevalenza di EPP potrebbe essere in aumento a causa di una migliore comprensione della malattia e di una migliore diagnosi. Si stima che circa 5.000-10.000 persone in tutto il mondo abbiano l'EPP. L'EPP è considerata la forma più comune di porfiria nei bambini. La prevalenza in Svezia è stata pubblicata come 1: 180.000.
Storia
La protoporfiria eritropoietica fu descritta per la prima volta nel 1953 da Kosenow e Treibs e completata nel 1960 da Magnus et al. presso il St John's Institute of Dermatology di Londra.
Guarda anche
Riferimenti
link esterno
- Protoporfiria eritropoietica presso NLM Genetics Home Reference
| Classificazione | |
|---|---|
| Risorse esterne |