Microscopia di contrasto di interferenza di fluorescenza - Fluorescence interference contrast microscopy
La microscopia a contrasto di interferenza di fluorescenza (FLIC) è una tecnica microscopica sviluppata per ottenere una risoluzione z su scala nanometrica.
Il FLIC si verifica ogni volta che oggetti fluorescenti si trovano in prossimità di una superficie riflettente (es. wafer di silicio). L'interferenza risultante tra la luce diretta e quella riflessa porta ad una doppia modulazione sin 2 dell'intensità, I, di un oggetto fluorescente in funzione della distanza, h, al di sopra della superficie riflettente. Ciò consente le misurazioni dell'altezza in nanometri .
Il microscopio FLIC è adatto per misurare la topografia di una membrana che contiene sonde fluorescenti, ad esempio un doppio strato lipidico artificiale , o una membrana cellulare vivente o la struttura di proteine marcate con fluorescenza su una superficie.
Teoria ottica FLIC
Sistema generale a due strati
La teoria ottica alla base di FLIC è stata sviluppata da Armin Lambacher e Peter Fromherz. Hanno derivato una relazione tra l' intensità di fluorescenza osservata e la distanza del fluoroforo da una superficie riflettente di silicio .
L'intensità di fluorescenza osservata, , è il prodotto della probabilità di eccitazione per unità di tempo, , e la probabilità di misurare un fotone emesso per unità di tempo, . Entrambe le probabilità sono una funzione dell'altezza del fluoroforo sopra la superficie del silicio, quindi l'intensità osservata sarà anche una funzione dell'altezza del fluoroforo. La disposizione più semplice da considerare è un fluoroforo incorporato nel biossido di silicio (indice di rifrazione ) a una distanza d da un'interfaccia con il silicio (indice di rifrazione ). Il fluoroforo è eccitato dalla luce della lunghezza d'onda ed emette luce della lunghezza d'onda . Il vettore unitario fornisce l'orientamento del dipolo di transizione di eccitazione del fluoroforo. è proporzionale alla proiezione al quadrato del campo elettrico locale , , che include gli effetti di interferenza , sulla direzione del dipolo di transizione.
Il campo elettrico locale, , al fluoroforo risente dell'interferenza tra la luce incidente diretta e la luce riflessa dalla superficie del silicio. L'interferenza è quantificata dalla differenza di fase data da
è l'angolo della luce incidente rispetto alla normale al piano del silicio. Non solo l'interferenza modula , ma la superficie del silicio non riflette perfettamente la luce incidente. I coefficienti di Fresnel danno la variazione di ampiezza tra un'onda incidente e un'onda riflessa. I coefficienti di Fresnel dipendono dagli angoli di incidenza, e , dagli indici di rifrazione dei due mezzi e dalla direzione di polarizzazione . Gli angoli e possono essere correlati dalla legge di Snell . Le espressioni per i coefficienti di riflessione sono:
TE si riferisce alla componente del campo elettrico perpendicolare al piano di incidenza e TM alla componente parallela (Il piano incidente è definito dalla normale al piano e dalla direzione di propagazione della luce). In coordinate cartesiane , il campo elettrico locale
è l'angolo di polarizzazione della luce incidente rispetto al piano di incidenza. L'orientamento del dipolo di eccitazione è funzione del suo angolo rispetto alla normale e azimutale rispetto al piano di incidenza.
Le due equazioni precedenti per e possono essere combinate per dare la probabilità di eccitare il fluoroforo per unità di tempo .
Molti dei parametri usati sopra varierebbero in un normale esperimento. La variazione nei cinque parametri seguenti dovrebbe essere inclusa in questa descrizione teorica.
- La coerenza della luce di eccitazione
- L'angolo di incidenza ( ) della luce di eccitazione
- Angolo di polarizzazione ( ) della luce di eccitazione
- L'angolo del dipolo di transizione ( ) del fluoroforo
- La lunghezza d'onda della luce di eccitazione ( )
La proiezione al quadrato deve essere mediata su queste quantità per dare la probabilità di eccitazione . La media sui primi 4 parametri dà
I fattori di normalizzazione non sono inclusi. è una distribuzione dell'angolo di orientamento dei dipoli fluorofori. L' angolo azimutale e l'angolo di polarizzazione sono integrati analiticamente, quindi non compaiono più nell'equazione di cui sopra. Per ottenere infine la probabilità di eccitazione per unità di tempo, l'equazione di cui sopra viene integrata sulla diffusione nella lunghezza d'onda di eccitazione, tenendo conto dell'intensità e del coefficiente di estinzione del fluoroforo .
I passaggi per calcolare sono equivalenti a quelli sopra nel calcolo, tranne per il fatto che le etichette dei parametri em vengono sostituite con ex e in viene sostituita con out .
L'intensità di fluorescenza risultante misurata è proporzionale al prodotto della probabilità di eccitazione e probabilità di emissione
È importante notare che questa teoria determina una relazione di proporzionalità tra l'intensità di fluorescenza misurata e la distanza del fluoroforo sopra la superficie riflettente. Il fatto che non sia una relazione di uguaglianza avrà un effetto significativo sulla procedura sperimentale.
Setup sperimentale
Un wafer di silicio viene tipicamente utilizzato come superficie riflettente in un esperimento FLIC. Uno strato di ossido viene quindi cresciuto termicamente sopra il wafer di silicio per fungere da distanziatore. Sopra l'ossido viene posto il campione marcato con fluorescenza, come una membrana lipidica, una cellula o proteine legate alla membrana. Con il sistema di campionamento costruito, tutto ciò che serve è un microscopio a epifluorescenza e una telecamera CCD per effettuare misurazioni quantitative dell'intensità.
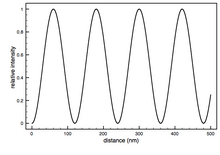
Lo spessore del biossido di silicio è molto importante per effettuare misurazioni FLIC accurate. Come accennato in precedenza, il modello teorico descrive l' intensità di fluorescenza relativa misurata rispetto all'altezza del fluoroforo. La posizione del fluoroforo non può essere semplicemente letta da una singola curva FLIC misurata. Il procedimento di base è quello di realizzare lo strato di ossido con almeno due spessori noti (lo strato può essere realizzato con tecniche fotolitografiche e lo spessore misurato mediante ellissometria ). Gli spessori utilizzati dipendono dal campione da misurare. Per un campione con altezza del fluoroforo nell'intervallo di 10 nm, lo spessore dell'ossido intorno a 50 nm sarebbe il migliore perché la curva di intensità FLIC è qui più ripida e produrrebbe il maggior contrasto tra le altezze dei fluorofori. Lo spessore dell'ossido superiore a poche centinaia di nanometri potrebbe essere problematico perché la curva inizia a essere macchiata dalla luce policromatica e da una gamma di angoli incidenti. Un rapporto delle intensità di fluorescenza misurate a diversi spessori di ossido viene confrontato con il rapporto previsto per calcolare l'altezza del fluoroforo sopra l'ossido ( ).
L'equazione di cui sopra può quindi essere risolta numericamente per trovare . Le imperfezioni dell'esperimento, come la riflessione imperfetta, l'incidenza anormale della luce e la luce policromatica tendono a macchiare le curve di fluorescenza taglienti. L'ampiezza dell'angolo di incidenza può essere controllata dall'apertura numerica (NA). Tuttavia, a seconda dell'apertura numerica utilizzata, l'esperimento produrrà una buona risoluzione laterale (xy) o una buona risoluzione verticale (z), ma non entrambe. Un'alta NA (~1.0) offre una buona risoluzione laterale che è la migliore se l'obiettivo è determinare la topografia a lungo raggio. NA basso (~0,001), d'altra parte, fornisce una misurazione accurata dell'altezza z per determinare l'altezza di una molecola marcata in modo fluorescente in un sistema.
Analisi
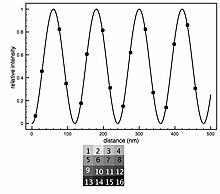
L'analisi di base prevede l' adattamento dei dati di intensità con il modello teorico che consente alla distanza del fluoroforo sopra la superficie dell'ossido ( ) di essere un parametro libero. Le curve FLIC si spostano a sinistra all'aumentare della distanza del fluoroforo sopra l'ossido. è solitamente il parametro di interesse, ma molti altri parametri liberi sono spesso inclusi per ottimizzare l'adattamento. Normalmente sono inclusi un fattore di ampiezza (a) e un termine additivo costante per lo sfondo (b). Il fattore di ampiezza scala l'intensità relativa del modello e lo sfondo costante sposta la curva verso l'alto o verso il basso per tenere conto della fluorescenza proveniente da aree fuori fuoco, come il lato superiore di una cella. Occasionalmente l'apertura numerica (NA) del microscopio può essere un parametro libero nell'adattamento. Gli altri parametri che entrano nella teoria ottica, come i diversi indici di rifrazione, gli spessori degli strati e le lunghezze d'onda della luce, sono assunti costanti con una certa incertezza. Un chip FLIC può essere realizzato con terrazze di ossido di 9 o 16 diverse altezze disposte in blocchi. Dopo che è stata acquisita un'immagine di fluorescenza, ogni blocco di 9 o 16 terrazze produce una curva FLIC separata che definisce un . La media si trova compilando tutti i valori in un istogramma.
L' errore statistico nel calcolo di deriva da due fonti: l'errore nell'adattamento della teoria ottica ai dati e l'incertezza nello spessore dello strato di ossido. L'errore sistematico deriva da tre fonti: la misurazione dello spessore dell'ossido (solitamente tramite ellissometro), la misurazione dell'intensità di fluorescenza con il CCD e l'incertezza nei parametri utilizzati nella teoria ottica. L'errore sistematico è stato stimato in .
Riferimenti
- Ajo-Franklin, Caroline M.; Yoshina-Ishii, Chiaki; Pugile, Steven G. (2005). "Sondaggio della struttura delle membrane supportate e degli oligonucleotidi legati mediante microscopia a contrasto di interferenza di fluorescenza". Langmuir . Società chimica americana (ACS). 21 (11): 4976–4983. doi : 10.1021/la0468388 . ISSN 0743-7463 . PMID 15896039 .
- Braun, D.; Fromherz, P. (1997-10-01). "Microscopia a contrasto di interferenza di fluorescenza di adesione cellulare su silicio ossidato". Fisica Applicata A: Scienza e lavorazione dei materiali . Springer Science and Business Media LLC. 65 (4-5): 341-348. Bibcode : 1997ApPhA..65..341B . doi : 10.1007/s003390050589 . ISSN 0947-8396 . S2CID 16478620 .
- Braun, Dieter; Fromherz, Peter (1998-12-07). "Interferometria a fluorescenza di adesione delle cellule neuronali su silicio microstrutturato". Lettere di revisione fisica . Società di fisica americana (APS). 81 (23): 5241–5244. Bibcode : 1998PhRvL..81.5241B . doi : 10.1103/physrevlett.81.5241 . ISSN 0031-9007 .
- gru, Jonathan M.; Kiessling, Volker; Tamm, Lukas K. (2005). "Misurazione dell'asimmetria lipidica in bistrati supportati planari mediante microscopia a contrasto di interferenza di fluorescenza". Langmuir . Società chimica americana (ACS). 21 (4): 1377–1388. doi : 10.1021/la047654w . ISSN 0743-7463 . PMID 15697284 .
- Kaizuka, Yoshihisa; Boschetti, Jay T. (2006-03-20). "Smorzamento idrodinamico delle fluttuazioni termiche della membrana vicino alle superfici riprese dalla microscopia a interferenza a fluorescenza". Lettere di revisione fisica . Società di fisica americana (APS). 96 (11): 118101. Bibcode : 2006PhRvL..96k8101K . doi : 10.1103/physrevlett.96.118101 . ISSN 0031-9007 . PMID 16605875 .
- Kiessling, Volker; Tamm, Lukas K. (2003). "Misurazione delle distanze nei doppi strati supportati mediante microscopia a contrasto di interferenza di fluorescenza: supporti polimerici e proteine SNARE" . Giornale Biofisico . Elsevier BV. 84 (1): 408-418. Bibcode : 2003BpJ....84..408K . doi : 10.1016/s0006-3495(03)74861-9 . ISSN 0006-3495 . PMC 1302622 . PMID 12524294 .
- Lambcher, Armin; Fromherz, Peter (1996). "Microscopia a contrasto di interferenza di fluorescenza su silicio ossidato utilizzando uno strato di colorante monomolecolare". Fisica Applicata A: Scienza e lavorazione dei materiali . Springer Science and Business Media LLC. 63 (3): 207-216. Bibcode : 1996ApPhA..63..207L . doi : 10.1007/bf01567871 . ISSN 0947-8396 . S2CID 16072847 .
- Lambcher, Armin; Fromherz, Peter (2002-06-01). "Luminescenza di molecole di colorante su silicio ossidato e microscopia a contrasto di interferenza di fluorescenza di biomembrane". Ufficiale Optical Society of America B . La Società Ottica. 19 (6): 1435–1453. Bibcode : 2002JOSAB..19.1435L . doi : 10.1364/josab.19.001435 . ISSN 0740-3224 .
- Parthasarathy, Raghuveer; Boschetti, Jay T. (2004). "Tecniche ottiche per la topografia a membrana di imaging". Biochimica e biofisica cellulare . Springer Science and Business Media LLC. 41 (3): 391-414. doi : 10.1385/cbb:41:3:391 . ISSN 1085-9195 . PMID 15509889 . S2CID 11674192 .

















![{\displaystyle F_{in}=\sin \gamma _{in}\left[{\begin{array}{c}0\\1+r_{10}^{TE}{\textit {e}}^{ i\Phi _{in}}\\0\end{array}}\right]+\cos \gamma _{in}\left[{\begin{array}{c}\cos \theta _{1}^ {in}(1-r_{10}^{TM}{\textit {e}}^{i\Phi _{in}})\\0\\\sin \theta _{1}^{in}( 1+r_{10}^{TM}{\textit {e}}^{i\Phi _{in}})\end{array}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5d258141c323a6fbb6d58ce55f627c2ce134ca5d)



![{\displaystyle {\textit {e}}_{ex}=\left[{\begin{array}{c}\cos \phi _{ex}\sin \theta _{ex}\\\sin \phi _ {ex}\sin \theta _{ex}\\\cos \theta _{ex}\end{array}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/94ef930957757dd028391812a8023e0c3438f552)