Equazione di Hill (biochimica) - Hill equation (biochemistry)
In biochimica e farmacologia , l' equazione di Hill si riferisce a due equazioni strettamente correlate che riflettono il legame dei ligandi alle macromolecole, in funzione della concentrazione del ligando . Un ligando è "una sostanza che forma un complesso con una biomolecola per servire uno scopo biologico" ( definizione di ligando ), e una macromolecola è una molecola molto grande, come una proteina, con una struttura complessa di componenti ( definizione di macromolecola ). Il legame proteina-ligando cambia tipicamente la struttura della proteina bersaglio, cambiando così la sua funzione in una cellula.
La distinzione tra le due equazioni di Hill è se misurano l' occupazione o la risposta . L' equazione di Hill-Langmuir riflette l'occupazione delle macromolecole: la frazione che è saturata o legata dal ligando . Questa equazione è formalmente equivalente all'isoterma di Langmuir . Al contrario, l' equazione di Hill propriamente detta riflette la risposta cellulare o tissutale al ligando: l'output fisiologico del sistema, come la contrazione muscolare.
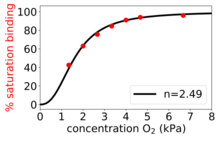
L'equazione di Hill-Langmuir è stata originariamente formulata da Archibald Hill nel 1910 per descrivere la curva di legame sigmoidale O 2 dell'emoglobina .
Il legame di un ligando a una macromolecola è spesso potenziato se sono già presenti altri ligandi sulla stessa macromolecola (questo è noto come legame cooperativo ). L'equazione di Hill-Langmuir è utile per determinare il grado di cooperatività del ligando(i) che si lega all'enzima o al recettore. Il coefficiente di Hill fornisce un modo per quantificare il grado di interazione tra i siti di legame del ligando.
L'equazione di Hill (per la risposta) è importante nella costruzione delle curve dose-risposta .
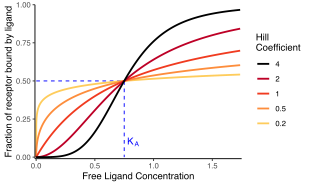
Percentuale di recettori legati al ligando
L'equazione di Hill-Langmuir è un caso speciale di un'iperbole rettangolare ed è comunemente espressa nei seguenti modi.
- ,
dove:
- è la frazione della concentrazione della proteina del recettore che è legata dal ligando ,
- è la concentrazione totale del ligando ,
- è l'apparente costante di dissociazione derivata dalla legge di azione di massa ,
- è la concentrazione del ligando che produce metà occupazione,
- è il coefficiente di Hill.
costanti
In farmacologia, è spesso scritto come , dove è il ligando, equivalente a L, ed è il recettore. può essere espresso in termini della quantità totale di concentrazioni di recettori e recettori legati al ligando: . è uguale al rapporto tra la velocità di dissociazione del complesso ligando-recettore e la sua velocità di associazione ( ). Kd è la costante di equilibrio per la dissociazione. è definita in modo che , questa è anche nota come costante di dissociazione microscopica ed è la concentrazione del ligando che occupa metà dei siti di legame. Nella letteratura recente, questa costante è talvolta indicata come .
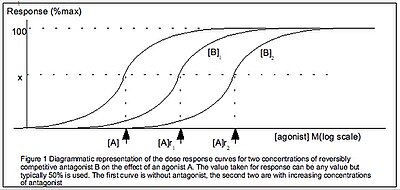
Equazione di Gaddum
L' equazione di Gaddum è un'ulteriore generalizzazione dell'equazione di Hill, che incorpora la presenza di un antagonista competitivo reversibile. L'equazione di Gaddum è derivata in modo simile all'equazione di Hill ma con 2 equilibri: sia il ligando con il recettore che l'antagonista con il recettore. Quindi, l'equazione di Gaddum ha 2 costanti: le costanti di equilibrio del ligando e quella dell'antagonista
Terreno collinare
Il diagramma di Hill è il riarrangiamento dell'equazione di Hill-Langmuir in una linea retta.
Prendendo il reciproco di entrambi i membri dell'equazione di Hill-Langmuir, riordinando e invertendo di nuovo si ottiene: . Prendendo il logaritmo di entrambi i membri dell'equazione si ottiene una formulazione alternativa dell'equazione di Hill-Langmuir:
- .
Quest'ultima forma dell'equazione di Hill-Langmuir è vantaggiosa perché un grafico di versus produce un grafico lineare , chiamato grafico di Hill. Poiché la pendenza di un diagramma di Hill è uguale al coefficiente di Hill per l'interazione biochimica, la pendenza è indicata con . Una pendenza maggiore di uno indica quindi un legame cooperativo positivamente tra il recettore e il ligando, mentre una pendenza minore di uno indica un legame cooperativo negativo.
Le trasformazioni di equazioni in forme lineari come questa erano molto utili prima dell'uso diffuso dei computer, poiché consentivano ai ricercatori di determinare i parametri adattando le linee ai dati. Tuttavia, queste trasformazioni influiscono sulla propagazione dell'errore e ciò può comportare un peso eccessivo rispetto all'errore nei punti dati vicino a 0 o 1. Ciò influisce sui parametri delle linee di regressione lineare adattate ai dati. Inoltre, l'uso dei computer consente un'analisi più robusta che coinvolge la regressione non lineare .
Risposta tissutale
Occorre fare una distinzione tra la quantificazione dei farmaci che si legano ai recettori e i farmaci che producono risposte. Potrebbe non esserci necessariamente una relazione lineare tra i due valori. In contrasto con la precedente definizione di questo articolo dell'equazione di Hill-Langmuir, l' IUPHAR definisce l'equazione di Hill in termini di risposta tissutale , come
dove è la concentrazione del farmaco ed è la concentrazione del farmaco che produce una risposta massima del 50%. Le costanti di dissociazione (nella sezione precedente) si riferiscono al legame del ligando, mentre riflette la risposta del tessuto.
Questa forma dell'equazione può riflettere le risposte di tessuto/cellula/popolazione ai farmaci e può essere utilizzata per generare curve dose-risposta . La relazione tra EC50 e può essere piuttosto complessa in quanto una risposta biologica sarà la somma di una miriade di fattori; un farmaco avrà un effetto biologico diverso se sono presenti più recettori, indipendentemente dalla sua affinità.
Il modello di Del-Castillo Katz viene utilizzato per mettere in relazione l'equazione di Hill-Langmuir con l'attivazione del recettore includendo un secondo equilibrio del recettore legato al ligando con una forma attivata del recettore legato al ligando.
L'analisi statistica della risposta in funzione dello stimolo può essere eseguita mediante metodi di regressione come il modello probit o il modello logit , o altri metodi come il metodo Spearman-Karber . I modelli empirici basati sulla regressione non lineare sono generalmente preferiti rispetto all'uso di qualche trasformazione dei dati che linearizza la relazione dose-risposta.
Coefficiente di collina
Il coefficiente di Hill è una misura dell'ultrasensibilità (cioè quanto è ripida la curva di risposta).
Il coefficiente di Hill, o , può descrivere la cooperatività (o forse altre proprietà biochimiche, a seconda del contesto in cui viene utilizzata l'equazione di Hill-Langmuir). Quando appropriato, il valore del coefficiente di Hill descrive la cooperatività del legame del ligando nel modo seguente:
- . Legame positivamente cooperativo : una volta che una molecola di ligando è legata all'enzima, la sua affinità per altre molecole di ligando aumenta. Ad esempio, il coefficiente di Hill del legame dell'ossigeno all'emoglobina (un esempio di cooperatività positiva) rientra nell'intervallo 1,7-3,2.
- . Legame cooperativo negativo : una volta che una molecola di ligando è legata all'enzima, la sua affinità per altre molecole di ligando diminuisce.
- . Legame non cooperativo (completamente indipendente) : l'affinità dell'enzima per una molecola di ligando non dipende dal fatto che altre molecole di ligando siano già legate o meno. Quando n=1, otteniamo un modello che può essere modellato dalla cinetica di Michaelis–Menten , in cui , la costante di Michaelis–Menten .
Il coefficiente di Hill può essere calcolato in termini di potenza come:
- .
dove e sono i valori di input necessari per produrre rispettivamente il 10% e il 90% della risposta massima.
Derivazione dalla cinetica dell'azione di massa
L'equazione di Hill-Langmuir è derivata in modo simile all'equazione di Michaelis Menten ma incorpora il coefficiente di Hill. Si consideri una proteina ( ), come l' emoglobina o un recettore proteico, con siti di legame per i ligandi ( ). Il legame dei ligandi alla proteina può essere rappresentato dall'espressione dell'equilibrio chimico:
- ,
dove (velocità diretta, o velocità di associazione del complesso proteina-ligando) e (velocità inversa, o velocità di dissociazione del complesso) sono le costanti di velocità di reazione per l'associazione dei ligandi alla proteina e la loro dissociazione dalla proteina, rispettivamente. Dalla legge dell'azione di massa , che a sua volta può essere derivata dai principi della teoria dell'urto , la costante di dissociazione apparente , una costante di equilibrio, è data da:
- .
Allo stesso tempo, il rapporto tra la concentrazione del recettore occupato e la concentrazione totale del recettore, è dato da:
- .
Utilizzando l'espressione ottenuta in precedenza per la costante di dissociazione, possiamo sostituire con per ottenere un'espressione semplificata per :
- ,
che è una formulazione comune dell'equazione di Hill.
Supponendo che il recettore proteico fosse inizialmente completamente libero (non legato) ad una concentrazione , quindi in qualsiasi momento, e . Di conseguenza, l'equazione di Hill-Langmuir è anche comunemente scritta come espressione per la concentrazione della proteina legata:
- .
Tutte queste formulazioni presuppongono che la proteina abbia siti a cui i ligandi possono legarsi. In pratica, tuttavia, il coefficiente di Hill raramente fornisce un'approssimazione accurata del numero di siti di legame del ligando su una proteina. Di conseguenza, è stato osservato che il coefficiente di Hill dovrebbe invece essere interpretato come un "coefficiente di interazione" che descrive la cooperatività tra i siti di legame del ligando.
Applicazioni
Le equazioni di Hill e Hill-Langmuir sono ampiamente utilizzate in farmacologia per quantificare i parametri funzionali di un farmaco e sono utilizzate anche in altre aree della biochimica.
L'equazione di Hill può essere utilizzata per descrivere le relazioni dose-risposta, ad esempio la probabilità di apertura del canale ionico (P-open) rispetto alla concentrazione del ligando.
Regolazione della trascrizione genica
L'equazione di Hill-Langmuir può essere applicata nel modellare la velocità con cui viene prodotto un prodotto genico quando il suo gene genitore è regolato da fattori di trascrizione (ad esempio attivatori e/o repressori ). Ciò è appropriato quando un gene è regolato da più siti di legame per i fattori di trascrizione, nel qual caso i fattori di trascrizione possono legare il DNA in modo cooperativo.
Se la produzione della proteina dal gene X è up-regolata ( attivata ) da un fattore di trascrizione Y , allora la velocità di produzione della proteina X può essere modellata come un'equazione differenziale in termini di concentrazione della proteina Y attivata :
- ,
dove k è il tasso di trascrizione genica massima di X .
Allo stesso modo, se la produzione di proteina dal gene Y è down-regolata ( repressa ) da un fattore di trascrizione Z , allora la velocità di produzione della proteina Y può essere modellata come un'equazione differenziale in termini di concentrazione della proteina Z attivata :
- ,
dove k è il tasso di trascrizione massimo del gene Y .
Limitazioni
A causa della sua ipotesi che le molecole di ligandi si legano a un recettore simultaneamente, l'equazione di Hill-Langmuir è stata criticata come un modello fisicamente irrealistico. Inoltre, il coefficiente di Hill non dovrebbe essere considerato un'approssimazione affidabile del numero di siti di legame cooperativo del ligando su un recettore tranne quando il legame del primo e dei successivi ligandi risulta in una cooperatività estremamente positiva.
A differenza dei modelli più complessi, l'equazione di Hill-Langmuir relativamente semplice fornisce poche informazioni sui meccanismi fisiologici sottostanti delle interazioni proteina-ligando. Questa semplicità, tuttavia, è ciò che rende l'equazione di Hill-Langmuir un utile modello empirico, poiché il suo utilizzo richiede poche conoscenze a priori sulle proprietà della proteina o del ligando oggetto di studio. Tuttavia, sono stati proposti altri modelli più complessi di legame cooperativo. Per ulteriori informazioni ed esempi di tali modelli, vedere Associazione cooperativa .
Le misure di sensibilità globale come il coefficiente di Hill non caratterizzano i comportamenti locali delle curve a forma di s. Invece, queste caratteristiche sono ben catturate dalla misura del coefficiente di risposta.
Esiste un collegamento tra il coefficiente di collina e il coefficiente di risposta, come segue. Altszyler et al. (2017) hanno dimostrato che queste misure di ultrasensibilità possono essere collegate.
Guarda anche
- Trama Bjerrum
- Rilegatura cooperativa
- Curva di Gompertz
- Modello di adsorbimento di Langmuir
- Funzione logistica
- Cinetica di Michaelis-Menten
- Equazione monodica
Appunti
Riferimenti
Ulteriori letture
- Dizionario medico illustrato di Dorland
- Coval, ML (dicembre 1970). "Analisi dei coefficienti di interazione di Hill e dell'invalidità dell'equazione di Kwon e Brown" . J. Biol. chimica 245 (23): 6335-6. doi : 10.1016/S0021-9258(18)62614-6 . PMID 5484812 .
- d'A Heck, Henry (1971). "Teoria statistica del legame cooperativo alle proteine. Equazione di Hill e il potenziale di legame". Marmellata. chimica Soc . 93 (1): 23-29. doi : 10.1021/ja00730a004 . PMID 5538860 .
- Atkins, Gordon L. (1973). "Un semplice programma di computer digitale per la stima del parametro dell'equazione di Hill" . Euro. J. Biochem . 33 (1): 175-180. doi : 10.1111/j.1432-1033.1973.tb02667.x . PMID 4691349 .
- Endrenyi, Laszlo; Kwong, FHF; Fajszi, Csaba (1975). "Valutazione delle pendenze della collina e dei coefficienti di collina quando il legame di saturazione o la velocità non sono noti" . Euro. J. Biochem . 51 (2): 317-328. doi : 10.1111/j.1432-1033.1975.tb03931.x . PMID 1149734 .
- Voet, Donald; Voet, Judith G. (2004). Biochimica .
- Weiss, JN (1997). "L'equazione di Hill rivisitata: usi e abusi" . Giornale FASEB . 11 (11): 835-841. doi : 10.1096/fasebj.11.11.9285481 . PMID 9285481 . S2CID 827335 .
- Kurganov, BI; Lobanov, AV (2001). "Criterio di validità dell'equazione di Hill per la descrizione delle curve di calibrazione del biosensore". Anale. Chim. Acta . 427 (1): 11-19. doi : 10.1016/S0003-2670(00)01167-3 .
- Gotelle, Sylvain; Maurizio, Michel; Rougier, Florent; Barbaut, Saverio; Bourguignon, Laurent; Ducher, Michel; Maire, Pascal (2008). "L'equazione di Hill: una revisione delle sue capacità nella modellazione farmacologica". Farmacologia fondamentale e clinica . 22 (6): 633–648. doi : 10.1111/j.1472-8206.2008.00633.x . PMID 19049668 . S2CID 4979109 .
- Gesztelyi R; Zsuga J; Kemeny-Beke A; Varga B; Juhasz B; Tosaki A (2012). "L'equazione di Hill e l'origine della farmacologia quantitativa". Archivio per la storia delle scienze esatte . 66 (4): 427-38. doi : 10.1007/s00407-012-0098-5 . S2CID 122929930 .
- Colquhoun D (2006). "L'analisi quantitativa delle interazioni farmaco-recettore: una breve storia". Trends Pharmacol Sci . 27 (3): 149-57. doi : 10.1016/j.tips.2006.01.008 . PMID 16483674 .
- Suonò HP (2006). "Il concetto di recettore: la grande idea della farmacologia" . Br J Pharmacol . 147 : S9-16. doi : 10.1038/sj.bjp.0706457 . PMC 1760743 . PMID 16402126 .

![{\displaystyle {\begin{allineato}\theta &={[{\ce {L}}]^{n} \over K_{d}+[{\ce {L}}]^{n}}\\ &={[{\ce {L}}]^{n} \over (K_{A})^{n}+[{\ce {L}}]^{n}}\\&={1 \ over 1+\left({K_{A} \over [{\ce {L}}]}\right)^{n}}\end{allineato}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/386ff885fdf558b83ca54868e1c90d7a27431451)

![{\displaystyle {\ce {[L]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b3d168a8fcf5a74047be127a23620e6c9a5534c1)






![{\displaystyle \theta ={\frac {[LR]}{[R_{\rm {totale}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a248ec0db4482331e558fa6a376b546a48ca62fe)





![{\displaystyle {\theta \over 1-\theta }={[{\ce {L}}]^{n} \over K_{d}}={[{\ce {L}}]^{n} \over (K_{A})^{n}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e62619f678cb95dde3c47e61e2aac4f144f10357)
![{\displaystyle {\begin{allineato}\log \left({\theta\over 1-\theta}\right)&=n\log {[{\ce {L}}]}-\log {K_{d }}\\&=n\log {[{\ce {L}}]}-n\log {K_{A}}\end{allineato}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/85e17bac0e7828741f0ce8943abbf129033f3fba)

![{\displaystyle \log {[{\ce {L}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc44efcd14530f15374d04ede7e01db63da3ac6b)


![{\displaystyle {\begin{allineato}{\frac {E}{E_{\mathrm {max} }}}&={\frac {[A]^{n}}{{\text{EC}}_{ 50}^{n}+[A]^{n}}}\\&={\frac {1}{1+\left({\frac {{\text{EC}}_{50}}{[ A]}}\right)^{n}}}\end{allineato}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e59f5002b0fc98cc03c0931e09ee8c937da865a2)
![{\displaystyle {\ce {[A]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/881146b6653b24508d87e34a81c84832f1d5ffea)











![{\displaystyle {\ce {{P}+{\mathit {n}}{L}<=>[k_{a}][k_{d}]{P}{L}_{\mathit {n}} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/30ac3fdcc0a8fffb8e177f213da2c5d9f48b3a29)


![{\displaystyle K_{\rm {d}}={k_{\rm {d}} \over k_{\rm {a}}}={{[{\rm {P}}][{\rm {L }}]^{\mathit {n}}} \over [{\rm {PL_{\mathit {n}}}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cee93ffd577008a7e660672d95224d18aee261d5)
![{\displaystyle \theta ={\mathrm {occupato\recettore} \over \mathrm {totale\recettore} }={[{\rm {PL_{\mathit {n}}}}] \over {[{\rm { P}}]\ +\ [{\rm {PL_{\mathit {n}}}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c3cd51c2f9c4a3453ad4a8bb3d71b65de7a3b3ae)
![{\textstyle [{\rm {PL_{\mathit {n}}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/91dd9940fe6058a28b52b197652f5357b8a71656)
![{\textstyle {[{\rm {P}}][{\rm {L}}]^{\mathit {n}} \over K_{\rm {d}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/947c1d0e40f3d1d66dc9b4091399022ed47df1f1)

![{\displaystyle \theta ={({[{\rm {P}}][{\rm {L}}]^{\mathit {n}} \over K_{\rm {d}}}) \over { [{\rm {P}}]\ +\ ({[{\rm {P}}][{\rm {L}}]^{\mathit {n}} \over K_{\rm {d}} })}}={{[{\rm {P}}][{\rm {L}}]^{\mathit {n}}} \over {K_{\rm {d}}[{\rm { P}}]\ +\ {[{\rm {P}}][{\rm {L}}]^{\mathit {n}}}}}={{[{\rm {L}}]^ {\mathit {n}}} \over {K_{\rm {d}}\ +\ {[{\rm {L}}]^{\mathit {n}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af78324baf693dfda9800174bb7e7128223ac710)
![{\textstyle [{\rm {P_{0}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0258fc1d1c94f7b8c9de307e1367a7a7533838cb)
![{\textstyle {[{\rm {P}}]+[{\rm {PL_{\mathit {n}}}}]}=[{\rm {P_{0}}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6365d11270f9dc2456a5ea6cc159189909d6552)
![{\textstyle \theta ={[{\rm {PL_{\mathit {n}}}}] \over {[{\rm {P_{0}}}]\ }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/02daf828c3a908319108a2bdb072f22df3a607ac)
![{\displaystyle [{\rm {PL_{\mathit {n}}}}]=[{\rm {P_{0}}}]\cdot {{[{\rm {L}}]^{\mathit { n}}} \over {K_{\rm {d}}\ +\ {[{\rm {L}}]^{\mathit {n}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b9d33d4a1f61aba5e9239d5cf1f78d8833bf55d)
![{\displaystyle {\mathrm {d} \over \mathrm {d} t}[{\rm {X_{prodotto}}}]=k\ \cdot {{[{\rm {Y_{attivo}}}]^ {\mathit {n}}} \over {(K_{A})^{n}\ +\ {[{\rm {Y_{attivo}}}]^{\mathit {n}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce8f1d4a7e5379a47f17d14efde6a9c497496bac)
![{\displaystyle {\mathrm {d} \over \mathrm {d} t}[{\rm {Y_{prodotto}}}]=k\ \cdot {{(K_{A})^{\mathit {n} }} \over {(K_{A})^{n}\ +\ {[{\rm {Z_{attivo}}}]^{\mathit {n}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c4fca0f3452f5c99014402ed5ed8f04e7286e4be)