Malattia di Castleman multicentrica idiopatica - Idiopathic multicentric Castleman disease
| Malattia di Castleman multicentrica idiopatica | |
|---|---|
| Altri nomi | Iperplasia dei linfonodi giganti, amartoma linfoide, iperplasia dei linfonodi angiofollicolari |
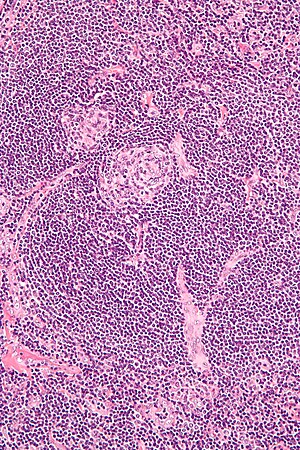 | |
| Micrografia della biopsia dei linfonodi che dimostra caratteristiche vascolari ialine compatibili con la malattia di Castleman | |
| Specialità | Ematologia, immunologia, reumatologia, patologia |
| Metodo diagnostico | Basato sulla storia del paziente, esame fisico, test di laboratorio, imaging medico, istopatologia |
| Frequenza | circa 1500-1800 nuovi casi all'anno negli Stati Uniti |
La malattia di Castleman multicentrica idiopatica (iMCD) è un sottotipo della malattia di Castleman (nota anche come iperplasia dei linfonodi giganti , amartoma linfoide o iperplasia dei linfonodi angiofollicolari ), un gruppo di malattie linfoproliferative caratterizzate da ingrossamento dei linfonodi , caratteristiche caratteristiche all'analisi microscopica di ingrandimento tessuto linfonodale e una serie di sintomi e reperti clinici.
Le persone con iMCD hanno linfonodi ingrossati in più regioni e spesso hanno sintomi simil-influenzali, risultati anormali negli esami del sangue e disfunzione di organi vitali, come fegato, reni e midollo osseo.
iMCD ha caratteristiche che si trovano spesso nelle malattie autoimmuni e nei tumori, ma il meccanismo della malattia sottostante è sconosciuto. Il trattamento per iMCD può comportare l'uso di una varietà di farmaci, inclusi immunosoppressori e chemioterapia.
La malattia di Castleman prende il nome dal dottor Benjamin Castleman , che per primo descrisse la malattia nel 1956. La Castleman Disease Collaborative Network è la più grande organizzazione focalizzata sulla malattia ed è coinvolta nella ricerca, nella sensibilizzazione e nel sostegno ai pazienti.
segni e sintomi
I pazienti con iMCD possono manifestare linfonodi ingrossati in più regioni linfonodali; sintomi sistemici (febbre, sudorazione notturna, perdita di peso involontaria, affaticamento); ingrossamento del fegato e / o della milza ; accumulo di liquido extravascolare alle estremità ( edema ), addome ( ascite ) o rivestimento dei polmoni ( versamento pleurico ); sintomi polmonari come tosse e mancanza di respiro; e reperti cutanei come emangiomi di ciliegia .
Cause
La causa dell'iMCD non è nota e non sono stati identificati fattori di rischio. Varianti genetiche sono state osservate nei casi di malattia di Castleman; tuttavia, nessuna variante genetica è stata convalidata come causa di malattia.
A differenza dell'MCD associato a HHV-8 , l'iMCD non è causato da un'infezione da HHV-8 incontrollata.
Meccanismo
Il meccanismo patologico dell'iMCD non è stato completamente descritto. È noto che l' interleuchina-6 (IL-6) , una molecola che stimola le cellule immunitarie, gioca un ruolo in alcuni casi di iMCD. I livelli di IL-6 misurati in alcuni pazienti con iMCD aumentano e diminuiscono con i corrispondenti cambiamenti nell'attività della malattia, i topi trattati con IL-6 sviluppano le caratteristiche dell'iMCD e il blocco della via IL-6 utilizzando i farmaci siltuximab e tocilizumab tratta efficacemente alcuni pazienti con iMCD. Tuttavia, molti pazienti con iMCD non mostrano livelli elevati di IL-6 e i livelli di IL-6 non sono fortemente correlati con la risposta al trattamento con farmaci anti-IL-6. Nei casi in cui IL-6 gioca un ruolo, la causa sottostante dei livelli elevati di IL-6 e le cellule responsabili della produzione di IL-6 rimangono sconosciute.
Diversi meccanismi teorici per iMCD sono stati proposti sulla base della ricerca esistente e sono state osservate somiglianze tra iMCD e altre malattie che presentano risultati clinici simili e istologia dei linfonodi:
- Autoimmune - Il sistema immunitario può produrre anticorpi che prendono di mira le cellule sane del corpo invece di batteri e virus. Gli anticorpi auto-diretti sono comunemente osservati nelle malattie autoimmuni come il lupus eritematoso sistemico e l'artrite reumatoide .
- Autoinfiammatorio - Una mutazione in un gene che controlla i sistemi infiammatori può contribuire all'attivazione dannosa delle vie infiammatorie nei pazienti con iMCD.
- Neoplastico - Le mutazioni genetiche che si sviluppano nelle cellule mature ( mutazioni somatiche ) possono causare una crescita eccessiva di cellule anormali come nei tumori come il linfoma .
- Patogeno - L'herpesvirus umano 8 (HHV-8) è l'agente eziologico noto dell'MCD associato a HHV-8, che presenta sintomi e risultati molto simili all'iMCD. Sebbene iMCD per definizione non sia causato da HHV-8, un virus sconosciuto può causare la malattia.
Non sono stati segnalati casi di trasformazione di UCD in iMCD.
Diagnosi
L'iMCD viene diagnosticato in base a criteri diagnostici di consenso basati sull'evidenza, che richiedono una valutazione approfondita tra cui anamnesi del paziente , esame fisico , test di laboratorio , imaging radiologico e analisi microscopica (istologia) del tessuto bioptico da un linfonodo ingrossato. La diagnosi di iMCD richiede anomalie cliniche, esclusione di altre malattie e una biopsia linfonodale che mostri caratteristiche coerenti con la malattia di Castleman. Una biopsia dei linfonodi da sola non è sufficiente per fare la diagnosi.
Test di laboratorio
I test di laboratorio possono dimostrare una proteina C reattiva elevata , livelli di emoglobina ridotti ( anemia ), livelli di albumina bassi, creatinina elevata , livelli di immunoglobuline aumentati e conte piastriniche anormali (elevate o diminuite) . I pazienti possono anche avere un aumento delle molecole coinvolte nell'infiammazione ( citochine ), come l' interleuchina 6 (IL-6) e il fattore di crescita dell'endotelio vascolare (VEGF) .
Imaging medico
L'imaging radiologico mostrerà i linfonodi ingrossati in più regioni, che sono tipicamente avidi di fluorodossiglucosio 18F (FDG) sulla tomografia a emissione di positroni (PET) .
Malattie associate
L'iMCD è comunemente visto nei pazienti con sindrome POEMS , ma non è chiaro se iMCD si manifesti come un processo patologico indipendente o una manifestazione della sindrome POEMS in questi pazienti. I pazienti con iMCD hanno un aumentato rischio di tumori solidi e tumori del sangue. Occasionalmente, i pazienti con iMCD presentano polmonite interstiziale linfocitica .
Sindrome TAFRO
pazienti con IMCD t hrombocytopenia, un nasarca, myelo f ibrosis, r disfunzioni enale, e o sindrome rganomegaly (TAFRO sindrome) sono considerati avere un sottotipo clinico distinto di IMCD. I pazienti spesso hanno una rapida progressione dei sintomi e spesso sviluppano una grave disfunzione d'organo. Rispetto ai pazienti iMCD senza sindrome TAFRO, i pazienti iMCD con sindrome TAFRO hanno maggiori probabilità di presentare dolore addominale grave, bassi livelli piastrinici, disfunzione renale progressiva e livelli di immunoglobuline da normali a moderatamente elevati. Mentre iMCD con sindrome TAFRO è stato descritto per la prima volta in pazienti giapponesi nel 2010, da allora sono stati segnalati casi di iMCD con sindrome TAFRO in pazienti non giapponesi in molti altri paesi.
Classificazione
La malattia di Castleman descrive un gruppo di almeno 3 disturbi distinti: la malattia di Castleman unicentrica (UCD), la malattia di Castleman multicentrica associata all'herpes virus umano 8 (MCD associato a HHV-8) e la malattia di Castleman multicentrica idiopatica (iMCD) . Identificare il sottotipo corretto della malattia è importante, poiché i tre disturbi variano in modo significativo in termini di sintomi, risultati clinici, meccanismo della malattia, approccio al trattamento e prognosi.
- Nella malattia di Unicentric Castleman i linfonodi ingrossati con caratteristici reperti microscopici sono presenti solo in una singola regione dei linfonodi.
- Nei sottotipi multicentrici della malattia di Castleman, i linfonodi ingrossati con reperti caratteristici sono presenti in più regioni linfonodali. Le varianti multicentriche della malattia di Castleman sono ulteriormente classificate in base alle cause note della malattia.
- L'MCD associato a HHV-8 è causato da un'infezione incontrollata da herpesvirus umano 8 (HHV-8).
- Nella malattia di Castleman multicentrica idiopatica (iMCD) la causa della malattia è sconosciuta ( idiopatica ). Il test per HHV-8 deve essere negativo per diagnosticare iMCD.
Malattia di Castleman multicentrica idiopatica
IMCD può essere ulteriormente differenziato dalla presenza di malattie associate, come p olyneuropathy, o rganomegaly, e ndocrinopathy, m proteina onoclonal, s kin cambia sindrome (sindrome POEMS), o dalle caratteristiche cliniche distinte, come t hrombocytopenia, un nasarca, myelo f ibrosis, r disfunzioni enale, e o sindrome rganomegaly (sindrome TAFRO).
Criteri diagnostici
La diagnosi di iMCD richiede: la presenza di entrambi i criteri principali, più regioni di linfonodi ingrossati come dimostrato dall'imaging medico; la presenza di almeno due criteri minori, di cui almeno uno deve essere un test di laboratorio anormale; ed esclusione di malattie che possono imitare iMCD.
Criteri principali 1: più regioni di linfonodi ingrossati
L'imaging radiologico deve mostrare linfonodi ingrossati in più regioni.
Principali criteri 2: analisi microscopica della biopsia linfonodale coerente con iMCD
L'aspetto microscopico (istologia) del tessuto sottoposto a biopsia da un linfonodo ingrossato deve dimostrare una costellazione di caratteristiche coerenti con la malattia di Castleman. Esistono tre modelli di caratteristiche istologiche caratteristiche associate all'iMCD:
- Ipervascolare: centri germinali regrediti , prominenza delle cellule dendritiche follicolari , ipervascolarizzazione nelle regioni interfollicolari e zone prominenti del mantello con un aspetto "a buccia di cipolla".
- Plasmocitica: aumento del numero di follicoli con grandi centri germinali iperplastici e plasmocitosi a foglio (aumento del numero di plasmacellule ).
- Misto: caratteristiche sia ipervascolari che plasmocitiche.
iMCD mostra più comunemente le caratteristiche plasmacitiche; tuttavia, nei linfonodi dell'iMCD possono essere osservate anche caratteristiche ipervascolari o un misto di caratteristiche sia ipervascolari che plasmocitiche. L'utilità clinica della sottotipizzazione di iMCD in base alle caratteristiche istologiche è incerta, poiché i sottotipi istologici non predicono in modo coerente la gravità della malattia o la risposta al trattamento.
La colorazione con l'antigene nucleare associato alla latenza (LANA-1) , un marker di infezione da HHV-8, deve essere negativa per diagnosticare iMCD.
Criteri minori
I pazienti devono sperimentare almeno due dei seguenti 11 criteri minori, di cui almeno uno è un test di laboratorio anormale.
Test di laboratorio:
- Elevata velocità di sedimentazione della proteina C reattiva o degli eritrociti
- Bassi livelli di emoglobina (anemia)
- Conta piastrinica anormale (bassa o alta)
- Bassi livelli di albumina
- Creatinina elevata
- Aumento dei livelli di immunoglobuline (ipergammaglobulinemia)
Caratteristiche cliniche:
- Sintomi influenzali
- Ingrandimento del fegato e / o della milza
- Accumulo di liquidi (edema, ascite, versamenti pleurici)
- Reperti cutanei come emangiomi di ciliegia o papule violacee
- Polmonite interstiziale linfocitica
Malattie da escludere
La diagnosi richiede l'esclusione di malattie che possono presentarsi con risultati clinici simili e aspetto simile all'analisi microscopica del tessuto da un linfonodo ingrossato. Le malattie che devono essere escluse nella diagnosi di iMCD includono malattie infettive, come la MCD associata a HHV-8 , la mononucleosi del virus di Epstein-Barr e la linfoadenopatia reattiva ; malattie autoimmuni, come il lupus eritematoso sistemico e l'artrite reumatoide ; e tumori, inclusi linfoma , mieloma multiplo e plasmocitoma linfonodale primario .
Trattamento
A causa della rarità dell'iMCD, i dati relativi al trattamento sono limitati e si basano su una combinazione di serie di casi osservazionali, case report e un singolo studio clinico randomizzato. A differenza dell'UCD, per il quale la chirurgia è il trattamento di scelta e curativo per la maggior parte dei pazienti, la chirurgia non è efficace nell'iMCD. Invece del trattamento chirurgico, viene utilizzata una varietà di farmaci in base alla gravità della malattia e alla risposta del paziente ai trattamenti precedenti. Siltuximab , un anticorpo monoclonale mirato all'IL-6 , è l'unico farmaco approvato dalla Food and Drug Administration (FDA) degli Stati Uniti per il trattamento dell'iMCD; tuttavia, in letteratura è stato riportato l'uso di successo di altri farmaci.
Nel 2018, le prime linee guida per il trattamento del consenso basato sull'evidenza per iMCD sono state pubblicate da un gruppo internazionale di esperti nel campo. Oltre a creare un algoritmo di trattamento per iMCD, queste linee guida di trattamento hanno stabilito definizioni comuni per la gravità della malattia e la risposta al trattamento.
Valutazione della gravità dell'iMCD
I pazienti con iMCD sono classificati come affetti da malattia grave o non grave in base ai 5 criteri elencati di seguito. I pazienti con 2 o più dei criteri seguenti sono classificati come affetti da malattia grave mentre i pazienti con 0-1 dei criteri sono classificati come affetti da malattia non grave.
- Performance status dell'Eastern Cooperative Oncology Group (ECOG) ≥ 2
- Velocità di filtrazione glomerulare stimata (eGFR) <30 o Creatinina> 3.0 mg / dL
- Anasarca e / o ascite e / o versamento pleurico e / o versamento pericardico
- Emoglobina ≤ 8,0 g / dL
- Coinvolgimento polmonare (ad es. Polmonite interstiziale con dispnea)
Risposta al trattamento
I pazienti con iMCD vengono valutati per la risposta al trattamento in base a cambiamenti nei sintomi, dimensioni dei linfonodi coinvolti e test di laboratorio. Ogni categoria è classificata come risposta completa, risposta parziale, malattia stabile o malattia progressiva. La risposta complessiva al trattamento è determinata dal grado di categoria più basso. Ad esempio, un paziente con una risposta di laboratorio completa , una risposta parziale ai sintomi e una risposta linfonodale completa riceverebbe una risposta al trattamento globale di risposta parziale . Vedi sotto per la descrizione dei criteri e la classificazione delle risposte.
Test di laboratorio
I test di laboratorio includono tutti i seguenti: proteina C-reattiva, emoglobina, albumina ed eGFR.
- Risposta completa: tutti i valori di laboratorio entro intervalli normali
- Risposta parziale -> 50% in tutti i valori di laboratorio
- Malattia stabile: tutti i valori di laboratorio compresi tra <50% di miglioramento e <25% di peggioramento
- Malattia progressiva -> 25% in peggioramento in qualsiasi valore di laboratorio
Sintomi
Quattro sintomi vengono valutati utilizzando i criteri comuni di terminologia degli eventi avversi del National Cancer Institute (versione 4): affaticamento, anoressia, febbre e peso corporeo
- Risposta completa - Normalizzazione al basale pre-malattia
- Risposta parziale - Miglioramento in tutti e 4 i sintomi, ma non al basale pre-malattia
- Malattia stabile - Miglioramento di almeno 1 (ma non tutti) i sintomi
- Malattia progressiva - peggioramento di almeno 1 sintomo su 2 o più valutazioni
Linfonodo
La risposta al trattamento per i linfonodi viene valutata utilizzando l'imaging radiologico e classificata come risposta completa, risposta parziale, malattia stabile e malattia progressiva in base ai criteri di Cheson modificati.
Algoritmo di trattamento
L'algoritmo di trattamento per iMCD si basa principalmente sulla gravità della malattia e sulla risposta al trattamento. A causa dell'elevato tasso di recidiva con l'interruzione del trattamento, la maggior parte dei pazienti con iMCD viene trattata con farmaci a tempo indeterminato.
Malattia non grave
Siltuximab, un bloccante dell'IL-6, è il trattamento raccomandato per tutti i pazienti con iMCD non grave indipendentemente dai livelli misurati di IL-6. Tocilizumab , un farmaco che prende di mira anche la via IL-6, è comunemente usato come alternativa a siltuximab quando siltuximab non è disponibile. I corticosteroidi possono essere aggiunti alla terapia anti-IL-6 a seconda della presentazione clinica. Il rituximab , un farmaco mirato ai linfociti B, è raccomandato principalmente come terapia di seconda linea per i pazienti che non rispondono a siltuximab o tocilizumab, ma può essere utilizzato come agente di prima linea nei pazienti appropriati.
Per i pazienti con malattia non grave che non rispondono a siltuximab, tocilizumab e rituximab, le raccomandazioni per il trattamento non sono ben definite. È stato riportato che le chemioterapie citotossiche inducono la remissione in pazienti con iMCD non grave; tuttavia, l'uso di chemioterapie citotossiche non è attualmente raccomandato per iMCD non grave a causa dell'elevata probabilità di recidiva e dei profili di effetti collaterali gravi. In alternativa, si raccomandano immunomodulatori come talidomide, ciclosporina A, sirolimus, bortezomib e anakinra a causa dei loro tassi di risposta simili e dei profili di effetti collaterali a lungo termine più favorevoli.
Grave malattia
Il trattamento iniziale raccomandato per tutti i pazienti con iMCD grave è costituito da steroidi ad alte dosi combinati con un agente anti-IL-6 come siltuximab o tocilizumab, indipendentemente dai livelli misurati di IL-6. Per i pazienti che migliorano immediatamente con questo regime, gli steroidi possono essere ridotti gradualmente, ma l'agente anti-IL-6 deve essere continuato a tempo indefinito a causa dell'elevato tasso di recidiva con l'interruzione del trattamento. A causa dell'alto rischio di complicanze associate a iMCD grave, se i pazienti peggiorano o non riescono a migliorare con alte dosi di steroidi e terapie anti-IL-6, si raccomandano regimi chemioterapici citotossici. I pazienti con malattie potenzialmente letali, in particolare quelli con sindrome TAFRO, possono richiedere misure avanzate come il supporto respiratorio con un ventilatore meccanico o il trattamento con dialisi per l'insufficienza renale.
Dopo il miglioramento dello stato della malattia, la terapia di mantenimento con un agente anti-IL-6 o un farmaco immunosoppressore viene tipicamente continuata a tempo indefinito, poiché la sospensione di tali farmaci può portare a ricadute.
Azione supplementare
I pazienti con iMCD richiedono una valutazione di routine della risposta al trattamento e della progressione della malattia. Si raccomanda che le visite di follow-up includano la valutazione dei sintomi, l'esame obiettivo, i test di laboratorio e l'imaging radiologico.
Prognosi
iMCD può presentarsi come una malattia acuta pericolosa per la vita in alcuni pazienti o una malattia cronica in altri. Alcuni pazienti hanno una malattia stabile di lunga data mentre altri soffrono di riacutizzazioni di malattia grave che possono migliorare con il trattamento. Un trattamento efficace controlla i sintomi e la disfunzione d'organo associati all'iMCD, migliora i sintomi e la disfunzione d'organo durante le riacutizzazioni della malattia e previene le riacutizzazioni future della malattia.
La sopravvivenza osservata in un recente studio su pazienti con iMCD è stata del 92% a 2 anni, del 76% a 5 anni e del 59% a 10 anni.
Epidemiologia
Ci sono circa 1500-1800 nuovi casi di iMCD diagnosticati all'anno negli Stati Uniti. L'iMCD può manifestarsi a qualsiasi età, ma l'età media alla presentazione è di circa 50 anni. C'è un lieve aumento dell'incidenza di iMCD nelle donne.
Non sono stati pubblicati studi epidemiologici sulla malattia di Castleman al di fuori degli Stati Uniti; tuttavia, non sono stati pubblicati dati che dimostrino un aumento o una diminuzione dell'incidenza della malattia di Castleman in specifiche regioni o etnie.
Storia
La malattia di Castleman è stata descritta per la prima volta dal dottor Benjamin Castleman nel 1956. La Giornata mondiale della malattia di Castleman è stata istituita nel 2018 e si tiene ogni anno il 23 luglio.
Cultura
La Castleman Disease Collaborative Network è stata fondata nel 2012 ed è la più grande organizzazione focalizzata sulla malattia di Castleman. È una rete collaborativa globale coinvolta nella ricerca, nella consapevolezza e nel sostegno ai pazienti.
Riferimenti
| Classificazione |
|---|
