Herpesvirus associato al sarcoma di Kaposi - Kaposi's sarcoma-associated herpesvirus
| Gammaherpesvirus umano 8 | |
|---|---|
|
|
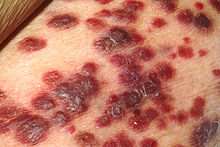
| Sarcoma di Kaposi | |
|
Classificazione dei virus |
|
| (non classificato): | Virus |
| regno : | Duplodnaviria |
| Regno: | Heunggongvirae |
| Filo: | Peploviricota |
| Classe: | Herviviricetes |
| Ordine: | Herpesvirales |
| Famiglia: | Herpesviridae |
| Genere: | Rhadinovirus |
| Specie: |
Gammaherpesvirus umano 8
|
L'herpesvirus associato al sarcoma di Kaposi ( KSHV ) è il nono herpesvirus umano conosciuto ; il suo nome formale secondo l' International Committee on Taxonomy of Viruses (ICTV) è Human gammaherpesvirus 8 , o in breve HHV-8 . Come altri herpesvirus, i suoi nomi informali sono usati in modo intercambiabile con il suo nome formale ICTV. Questo virus causa il sarcoma di Kaposi , un cancro che si verifica comunemente nei pazienti con AIDS , così come il linfoma da versamento primario , la malattia di Castleman multicentrica associata all'HHV-8 e la sindrome da citochine infiammatorie KSHV . È uno dei sette virus cancerogeni umani attualmente conosciuti, o oncovirus . Anche dopo tanti anni dalla scoperta di KSHV/HHV8, non esiste una cura nota per la tumorigenesi associata a KSHV.
Storia
Nel 1872, Moritz Kaposi descrisse un tumore dei vasi sanguigni (originariamente chiamato "sarcoma multipigmentato idiopatico della pelle") che da allora è stato chiamato omonimo sarcoma di Kaposi (KS). Inizialmente si pensava che il KS fosse un tumore raro delle popolazioni ebraiche e mediterranee fino a quando non fu successivamente determinato che era estremamente comune tra le popolazioni dell'Africa subsahariana. Ciò ha portato ai primi suggerimenti negli anni '50 che questo tumore potrebbe essere causato da un virus. Con l'inizio dell'epidemia di AIDS nei primi anni '80, c'è stata un'improvvisa recrudescenza di KS che ha colpito principalmente pazienti affetti da AIDS gay e bisessuali, con fino al 50% dei pazienti con AIDS segnalati con questo tumore, un tasso straordinario di predisposizione al cancro.
Un'attenta analisi dei dati epidemiologici di Valerie Beral, Thomas Peterman e Harold Jaffe, ha portato questi ricercatori a proporre che il KS sia causato da un virus sconosciuto a trasmissione sessuale che raramente causa tumori a meno che l'ospite non diventi immunodepresso , come nell'AIDS.
Già nel 1984, gli scienziati hanno riferito di aver visto strutture simili all'herpesvirus nei tumori KS esaminati al microscopio elettronico . Gli scienziati stavano cercando l'agente che causa il KS e oltre 20 agenti sono stati proposti come possibile causa, inclusi il citomegalovirus e lo stesso HIV . L'agente patogeno è stato infine identificato nel 1994 da Yuan Chang e Patrick S. Moore , un team di moglie e marito della Columbia University , attraverso l'isolamento di frammenti di DNA da un herpesvirus trovato in un tumore KS in un paziente affetto da AIDS. Chang e Moore hanno utilizzato l' analisi delle differenze rappresentazionali , o RDA, per trovare KSHV confrontando il tessuto tumorale KS di un paziente affetto da AIDS con il proprio tessuto non affetto. L'idea alla base di questo esperimento era che se un virus causa KS, il DNA genomico nei due campioni dovrebbe essere esattamente identico ad eccezione del DNA appartenente al virus. Nel loro esperimento RDA iniziale, hanno isolato due piccoli frammenti di DNA che rappresentavano meno dell'1% dell'effettivo genoma virale. Questi frammenti erano simili (ma ancora distinti dalle) sequenze note di herpesvirus, indicando la presenza di un nuovo virus. Partendo da questi frammenti, questo gruppo di ricerca è stato poi in grado di sequenziare l'intero genoma del virus meno di due anni dopo.
La scoperta di questo herpesvirus ha suscitato notevoli controversie e lotte scientifiche interne fino a quando non sono stati raccolti dati sufficienti per dimostrare che in effetti il KSHV era l'agente eziologico del sarcoma di Kaposi. Il virus è ora noto per essere un'infezione diffusa tra le persone che vivono nell'Africa sub-sahariana; livelli intermedi di infezione si verificano nelle popolazioni mediterranee (compresi Libano, Arabia Saudita, Italia e Grecia) e bassi livelli di infezione si verificano nella maggior parte delle popolazioni del Nord Europa e del Nord America. Gli uomini gay e bisessuali sono più suscettibili all'infezione (attraverso vie di trasmissione sessuale ancora sconosciute) mentre il virus viene trasmesso per vie non sessuali nei paesi in via di sviluppo.
Virologia
KSHV è un herpesvirus , ed è un grande virus a DNA a doppio filamento con un rivestimento proteico che racchiude i suoi acidi nucleici, chiamato capside , che è poi circondato da uno strato proteico amorfo chiamato tegumento , e infine racchiuso in un involucro lipidico derivato in parte dalla membrana cellulare. KSHV ha un genoma lungo circa 165.000 basi di acido nucleico. KSHV è un rhadinovirus , un genere di Herpes notevole poiché ha rubato numerosi geni dalle cellule ospiti, incluso nel caso dei geni KSHV che codificano per la proteina legante il complemento , IL-6 , BCL-2 , ciclina -D, una proteina G accoppiata recettore , fattore di regolazione dell'interferone e proteina inibitoria di Flice ( FLIP ), nonché proteine di sintesi del DNA tra cui diidrofolato reduttasi , timidina chinasi , timidilato sintetasi , DNA polimerasi e molte altre. Sebbene nessun altro virus tumorale umano possieda questi stessi geni, altri virus tumorali prendono di mira gli stessi percorsi cellulari, il che dimostra che a un livello di base, tutti i virus tumorali sembrano attaccare gli stessi percorsi di controllo cellulare, i cosiddetti percorsi oncosoppressori.
Dopo l'infezione, il virus entra nei linfociti tramite i macropinosomi dove rimane in uno stato latente ("quieto"). Solo un sottoinsieme di geni codificati nella regione associata alla latenza KSHV (KLAR) sono espressi durante la latenza, inclusi l'antigene nucleare associato alla latenza (LANA), vFLIP, vCyclin e 12 microRNA. La latenza è il segno distintivo di tutte le eziologie associate a KSHV conosciute fino ad oggi, inclusa tutta l'oncogenesi associata a KSHV. È stato dimostrato che entrambi i geni codificanti proteine tale e il gene non codificante (microRNA) codificato nella regione KLAR sono importanti per la tumorigenesi associata a KSHV. Per studiare le funzioni del microRNA, i principali ricercatori del settore hanno stabilito un protocollo dettagliato di mutagenesi bacmide e un set completo di linee cellulari che trasportano mutanti di delezione di microRNA, che sono disponibili come risorsa per qualsiasi ricercatore internazionale che lavori nel campo dei virus -cancro associato. Inoltre, in un altro studio, è stato dimostrato che vFLIP e vCyclin interferiscono indirettamente con la via di segnalazione del TGF-β inducendo il cluster mir17-92 dell'ospite oncogeno. Queste osservazioni rappresentano un nuovo meccanismo che può essere importante per la tumorigenesi e l'angiogenesi di KSHV, un segno distintivo di KS. Lo sviluppo di strumenti cruciali come un set completo di 12 mutanti di delezione di microRNA è uno sviluppo importante nello studio delle funzioni del gene KLAR nel contesto della tumorigenesi associata a KSHV Cruciale per l'ingresso del KSHV è il recettore EPH A2 , Hrs, TSG101 e alcune integrine , la cui identità deve ancora essere confermata. Il virus esiste come un pezzo circolare di DNA chiamato episoma e utilizza il meccanismo di replicazione cellulare per replicarsi. LANA è l'unica proteina virale necessaria per la replicazione del DNA del virus durante la latenza. L'episoma virale è cromatinizzato all'ingresso nel nucleo della cellula ospite. LANA lega il DNA virale ai cromosomi cellulari, inibisce la p53 e la proteina del retinoblastoma e sopprime i geni virali necessari per la produzione e l'assemblaggio completo del virus ("replicazione litica"). Perché solo un sottoinsieme di geni virali espressi durante la latenza non è completamente compreso. Ma è stato dimostrato che l'espressione genica associata alla latenza può essere spiegata in parte da uno stato epigenetico caratteristico che l'episoma di KSHV acquisisce durante la latenza. LANA gioca un ruolo importante durante la latenza. È dimostrato che regola le trascrizioni sia dell'ospite che del virus e si lega a più promotori attivi inclusi i promotori dell'ospite durante la latenza. Nello stesso studio, è stato anche dimostrato che LANA si associa al macchinario ospite hSET1 che crea segni H3K4me3. Tuttavia, il meccanismo esatto per cui la regione KLAR rimane attiva durante la latenza non è noto. È anche dimostrato che vari segnali come l'infiammazione possono provocare l'ingresso del virus nella replicazione litica. Quando si verifica la replicazione litica, l'episoma virale inizia a replicarsi sotto forma di molecole di DNA lineare che vengono impacchettate in particelle virali che vengono espulse dalla cellula, per infettare nuove cellule o per essere trasmesse a un nuovo ospite. Quando il virus entra nella replicazione litica, migliaia di particelle virali possono essere prodotte da una singola cellula, il che di solito provoca la morte della cellula infetta.
Il genoma virale è costituito da una regione unica lunga ~ 145 kilobase , che codifica tutti i geni virali espressi, che è affiancata da ~ 20-30 kilobasi di sequenze ripetute terminali. Ciascuna unità di ripetizione terminale è lunga 801 bp, ha un contenuto di G+C dell'85% ed è orientata in modo ripetitivo dalla testa alla coda. Durante la latenza, il genoma del virus dipende dal meccanismo di replicazione dell'ospite e si replica come un episoma circolare chiuso ("plasmide") utilizzando sequenze all'interno delle ripetizioni terminali come origine di replicazione. Quando il virus si riattiva nella replicazione litica, si ritiene che il genoma del virus venga replicato come una molecola lineare continua fuori da un episoma (il cosiddetto modello del cerchio rotante). Quando ogni unità di genoma viene replicata, viene tagliata all'interno della regione di ripetizione terminale e quindi confezionata in una particella virale (virione). Il virus viene quindi avvolto da una membrana lipidica mentre transita nel nucleo e nel citoplasma per uscire dalla cellula. Pertanto, mentre il genoma di KSHV è circolare nel nucleo delle cellule infettate in modo latente, è impacchettato in virus infettivi come una molecola lineare. Una volta che il virus infetta nuovamente una cellula, la membrana lipidica viene eliminata e il virione viaggia verso il nucleo. Il genoma virale viene rilasciato dove ricircola attraverso un processo poco conosciuto che sembra coinvolgere la ricombinazione omologa .
La proteina virale primaria responsabile del passaggio dalla replicazione latente a quella litica è nota come attivatore della transattivazione della replicazione ORF50 (RTA). Quando le condizioni di segnalazione cellulare attivano la generazione di RTA, a sua volta attiva la sintesi di una cascata stereotipata di proteine virali secondarie e terziarie che alla fine costituiscono i componenti del capside virale e anche gli enzimi di sintesi del DNA necessari per replicare il genoma del virus.
COVID-19 e KSHV
È stato scoperto nel 2020 che l'infezione con il virus SARS-CoV-2 , il virus che causa il COVID-19 , può indurre la riattivazione litica di KSHV nel corpo umano, causando la cessazione della latenza del virus dell'herpes e l'inizio della formazione di cellule cancerose . Inoltre, è stato scoperto che alcuni farmaci usati per trattare l'infezione da SARS-CoV-2, vale a dire Nafamostat e Azitromicina , hanno finito per promuovere la produzione di virioni maturi, "... potenzialmente inducendo la riattivazione litica di KSHV".
Fisiopatologia
I meccanismi con cui si contrae il virus non sono ben compresi. Gli individui sani possono essere infettati dal virus e non mostrare segni o sintomi, a causa della capacità del sistema immunitario di tenere sotto controllo l'infezione. L'infezione è di particolare interesse per gli immunocompromessi . I malati di cancro sottoposti a chemioterapia, i malati di AIDS e i pazienti sottoposti a trapianto di organi sono tutti ad alto rischio di mostrare segni di infezione.
I recenti progressi nelle tecnologie di sequenziamento hanno scoperto che il virus è cromatinizzato durante la latenza. È stato anche dimostrato che il microRNA codificato dal virus manipola e interagisce non solo con l'mRNA dell'ospite, ma anche deregolamenta l'RNA lungo non codificante dell'ospite (lncRNA). Più recentemente, sono stati scoperti di recente RNA circolari (circRNA) sia in EBV che in KSHV
Si pensa che l'infezione da questo virus duri per tutta la vita, ma un sistema immunitario sano manterrà il virus sotto controllo. Molte persone infette da KSHV non mostreranno mai alcun sintomo. Il sarcoma di Kaposi si verifica quando qualcuno che è stato infettato da KSHV diventa immunocompromesso a causa dell'AIDS, delle cure mediche o, molto raramente, dell'invecchiamento.
KSHV è un noto agente eziologico di quattro malattie:
- Sarcoma di Kaposi - un tumore angioproliferativo che può coinvolgere la pelle (il più delle volte), i linfonodi o i visceri,
- Malattia di Castleman multicentrica associata a HHV-8 - una malattia linfoproliferativa ,
- Linfoma a effusione primaria - Linfoma aggressivo associato a KSHV che coinvolge le cellule B che sono plasmacellule immature chiamate plasmablasti e considerate un tipo di neoplasie linfoidi con differenziazione plasmablastica ,
- Sindrome da citochine infiammatorie KSHV – una sindrome con sintomi simili a MCD ma senza patologia associata.
Epidemiologia
Negli anni '70, il tasso di prevalenza globale dell'HHV-8 è compreso tra il 2 e il 10%. La sieroprevalenza dell'HHV-8 varia in modo significativo geograficamente e i tassi di infezione nei paesi dell'Europa settentrionale, del sud-est asiatico e dei Caraibi sono tra il 2-4%, nei paesi mediterranei a circa il 10% e nei paesi dell'Africa subsahariana a circa il 40%. In Sud America, i tassi di infezione sono generalmente bassi, ma sono alti tra gli amerindi . Anche all'interno dei singoli paesi, si possono osservare variazioni significative tra le diverse regioni, con tassi di infezione di circa il 19,2% nello Xinjiang rispetto a circa il 9,5% nell'Hubei , in Cina. Sebbene sia stato costantemente dimostrato che la sieroprevalenza aumenta con l'età in modo lineare, i paesi con alti tassi di infezione possono vedere una maggiore sieroprevalenza nei gruppi di età più giovani. Il livello di istruzione ha mostrato una correlazione inversa con i tassi di infezione. Gli individui infetti da HIV-1 o condilomi genitali hanno generalmente maggiori probabilità di essere co-infetti da HHV-8.
Nei paesi con bassa sieroprevalenza, l'HHV-8 è principalmente limitato ai pazienti con AIDS e KS. Nei paesi con elevata sieroprevalenza, l'infezione è frequente nell'infanzia, indicando una probabile trasmissione da madre a figlio per via salivare. In un sondaggio dello Zambia , tutti i bambini con KS avevano madri positive per HHV-8, mentre non tutti i bambini le cui madri avevano KS erano positivi per HHV-8. In un'altra indagine dello Zambia, il 13,8% dei bambini era sieropositivo per HHV-8 all'età di 4 anni. Non è stato dimostrato che la sieroprevalenza vari in modo significativo a causa del sesso o dello stato civile.
Evoluzione
Si stima che il più recente antenato comune di questo virus nel Mediterraneo, in Iran e nello Xinjiang, in Cina, si sia evoluto 29.872 anni (densità di probabilità massima del 95% 26.851-32.760 anni) fa. l'antenato comune più recente per i virus isolati nello Xinjiang risale a 2037 anni (densità di probabilità massima del 95% 1843-2229 anni) fa. Dati i legami storici tra il Mediterraneo e lo Xinjiang durante il periodo romano , sembra probabile che questo virus sia stato introdotto nello Xinjiang lungo la Via della Seta . Il tasso di mutazione è stato stimato in 3,44 × 10 -6 sostituzioni per sito all'anno (densità di probabilità massima del 95% da 2,26 × -6 a 4,71 × 10 -6 ). Tuttavia, la distribuzione globale dei diversi genotipi di KSHV e il potenziale percorso di trasmissione necessitano di ulteriori studi.
La tipizzazione degli isolati si basa sulla proteina di membrana variabile K1. Sono riconosciuti sei tipi (AF).
Prevenzione
Poiché le persone infette da KSHV trasmettono il virus in modo asintomatico, i partner sessuali dovrebbero usare cautela nell'avere rapporti sessuali non protetti e attività in cui la saliva potrebbe essere condivisa durante l'attività sessuale. Un consiglio prudente è usare il preservativo quando necessario ed evitare baci profondi con partner con infezioni da KSHV e HIV o il cui stato è sconosciuto. Esistono esami del sangue per rilevare gli anticorpi contro il virus.
Trattamento
Il sarcoma di Kaposi è solitamente un tumore localizzato che può essere trattato chirurgicamente o mediante irradiazione locale. Può essere utilizzata la chemioterapia con farmaci come le antracicline liposomiali o il paclitaxel , in particolare per le malattie invasive. I farmaci antivirali, come il ganciclovir , che mirano alla replicazione degli herpesvirus come il KSHV sono stati utilizzati per prevenire con successo lo sviluppo del sarcoma di Kaposi, sebbene una volta che il tumore si sviluppa questi farmaci sono di scarsa o nulla utilità. Per i pazienti con AIDS-KS, la terapia più efficace è la terapia antiretrovirale altamente attiva per ridurre l'infezione da HIV. I pazienti con AIDS che ricevono un adeguato trattamento anti-HIV possono avere una riduzione fino al 90% dell'insorgenza del sarcoma di Kaposi.
Sebbene KSHV colpisca il sistema immunitario dell'ospite, ci sono ampie possibilità che l'intervento clinico recuperi questo cambiamento. Una sfida è la sovraespressione inibitoria della repressione delle cellule bersaglio immunitarie. Sotto stimolazione infiammatoria di lunga data, la cellula bersaglio non è in grado di rispondere, il che porta a un fenotipo esaurito. Le immunoterapie di attivazione possono rianimare e migliorare la funzione delle cellule immunitarie. Rispetto ad altre immunoterapie, le terapie mirate alla proteina 1 della morte cellulare programmata ( PD-1 )/ligando della morte programmata 1 ( PD-L1 ) hanno avuto un grande successo. A causa dell'infezione da KSHV, i monociti aumentano l'espressione di PD-1, che è una molecola inibitoria, e causano la fuga immunitaria in molti tipi di tumore. C'è un'elevata espressione di PD-1 nelle cellule NK di pazienti con KS-HIV e causa fenotipo esaurito. L'anticorpo anti-PD-1, ( nivolumab o pembrolizumab ), ha dimostrato un significativo effetto antitumorale. Nivolumab è attualmente uno studio clinico di fase I in corso e Pembrolizumab ha dimostrato la sua funzione nel trattamento di pazienti con HIV e KS in fase I ed è in uno studio di fase II per il trattamento. Un medicinale analogo alla talidomide - Pomalidomide è stato anche concesso dalla FDA nel 2011. È stato dimostrato che pomalidomide recupera l'espressione di MHC-1 , che aiuta le cellule a mostrare le proteine intracellulari alle cellule T citotossiche, e può anche reprimere l'espressione di PD-L1 e aumentare l'uccisione delle cellule T CD8+.
Geni KSHV
KSHV codifica per ~90 geni e più RNA non codificanti, come i microRNA. I geni "ORF" sono denominati in base alla posizione del genoma dei geni omologhi nel primo rhadinovirus descritto, herpesvirus saimiri. I geni "K" sono unici per KSHV, alcuni geni KSHV hanno funzioni ben caratterizzate, mentre altri rimangono atipici.
ORF2 – diidrofolato reduttasi
ORF8 – gB – glicoproteina dell'involucro coinvolta nell'ingresso virale
ORF9 – Pol8 – DNA polimerasi richiesta per la replicazione del DNA virale
ORF10 – regola l'esportazione di RNA e le risposte agli IFN di tipo I
ORF16 – v Bcl2
ORF18, ORF24, ORF30, ORF31, ORF34, ORF66 - fattori di trascrizione virale richiesti per l'espressione di geni tardivi
ORF21 – vTK – timidina chinasi
ORF22 – gH – glicoproteina dell'involucro coinvolta nell'ingresso virale
ORF23 – non caratterizzato
ORF25, ORF26 e ORF65 – proteine del capside
ORF33 – coinvolto nella formazione di particelle virali
ORF34 – funzione poco chiara
ORF35 – funzione poco chiara, il mutante non esprime geni virali precoci
ORF36 – vPK – protein chinasi virale con molteplici ruoli nel ciclo di replicazione
ORF37 – SOX – proteina a doppia funzione – L' attività della DNasi richiesta per il confezionamento del genoma e l' attività della RNasi regola l'espressione genica dell'ospite
ORF38 – coinvolto nella formazione di particelle virali
ORF39 – gM – glicoproteina dell'involucro
ORF40 e ORF41 – elicasi e primasi – replicazione del DNA
ORF42 – non caratterizzato
ORF45 - proteina del tegumento , lega e previene la defosforilazione delle chinasi S6 ribosomiali p90 (RSK) e ERK per modulare la via di segnalazione ERK/RSK MAPK
ORF47 – gL – glicoproteina dell'involucro coinvolta nell'ingresso virale
ORF49 – può essere richiesto per l'espressione genica virale
ORF50 - RTA, attivatore di replicazione e trascrizione - il principale fattore di trascrizione che guida la riattivazione litica di KSHV
ORF52 – KicGAS – proteina del tegumento necessaria per la formazione di virioni e l'inibizione del rilevamento del DNA cGAS
ORF53 – gN – glicoproteina dell'involucro
ORF55 – non caratterizzato
ORF57 – MTA – regola la stabilità dell'RNA, l'esportazione e la traduzione dei geni virali
ORF59 – PF–8 – fattore di processività della polimerasi, subunità accessoria della DNA polimerasi virale
ORF67 e ORF69 – uscita nucleare
ORF70 – timidilato sintasi
ORF72 – v Cyclin
ORF73 – LANA , antigene nucleare associato alla latenza – lega il genoma al cromosoma durante la latenza, regola anche l'espressione genica dell'ospite. Una forma citoplasmatica di LANA può inibire l'attivazione delle risposte immunitarie.
ORF74 – vGPCR
ORF75 – FGARATI
PAN, RNA nucleare poliadenilato – RNA lineari e circolari non codificanti
miRNA (mirK) – microRNA virali espressi durante la latenza per regolare la proliferazione e la morte cellulare
K1 – coinvolto nell'oncogenesi
K2 - Interleuchina 6 omologo, Q2HRC7
K3 e K5 – ubiquitina E3 ligasi – regolano la presentazione dell'antigene
K4 – vCCL2 – chemochina
K4.1 – vCCL3 – chemochina
K8 – repressore trascrizionale – modula la cromatina
K8.1 – glicoproteina dell'involucro
K9 – v IRF 1, fattore di regolazione dell'interferone virale 1
K10 – v IRF 4. Anche un RNA circolare ( circRNA ) viene generato da questo locus .
K10.5 – v IRF 3 (inizialmente designato LANA2), è espresso durante la latenza nelle linee cellulari PEL, ma è anche un vero fattore litico, come tutti i vIRF.
K11 – v IRF 2
K12 – kaposina
K13 – v FLIP
Guarda anche
- Oncovirus (virus del cancro)
- 22° Workshop internazionale su Karposi Sarcoma Herpesvirus (KSHV) e agenti correlati , 30 giugno – 3 luglio 2019, New York City, USA
- Il paradosso del fumatore
Riferimenti
Ulteriori letture
- Edelman DC (2005). "Herpesvirus umano 8 - Un nuovo agente patogeno umano" . Giornale di virologia . 2 : 78. doi : 10.1186/1743-422X-2-78 . PMC 1243244 . PMID 16138925 .
link esterno
- Human Herpesvirus-8: risorse correlate HIV InSite
- KSHV Annual Workshop 22nd International Workshop on Karposi Sarcoma Herpesvirus (KSHV) and Related Agents, 30 giugno – 3 luglio 2019, New York City, USA

