Canale del calcio di tipo L - L-type calcium channel
| Canale del calcio, dipendente dalla tensione | |
|---|---|
 Struttura cristallografica
| |
| Identificatori | |
| Simbolo | Canale del calcio, dipendente dalla tensione |

Il canale del calcio di tipo L (noto anche come canale diidropiridinico o canale DHP ) fa parte della famiglia dei canali del calcio voltaggio-dipendenti attivati dall'alta tensione . "L" sta per long lasting riferito alla durata dell'attivazione. Questo canale ha quattro subunità ( Cav1.1 , Cav1.2 , Cav1.3 , Cav1.4 ).
I canali del calcio di tipo L sono responsabili dell'accoppiamento eccitazione- contrazione del muscolo scheletrico , liscio , cardiaco e della secrezione di aldosterone nelle cellule endocrine della corteccia surrenale . Si trovano anche nei neuroni e, con l'aiuto dei canali del calcio di tipo L nelle cellule endocrine, regolano i neurormoni e i neurotrasmettitori . È stato anche osservato che svolgono un ruolo nell'espressione genica, nella stabilità dell'mRNA, nella sopravvivenza neuronale, nel danno assonale indotto dall'ischemia, nell'efficacia sinaptica e nell'attivazione e disattivazione di altri canali ionici.
Nei miociti cardiaci, il canale del calcio di tipo L passa verso l'interno della corrente Ca 2+ e innesca il rilascio di calcio dal reticolo sarcoplasmatico attivando il recettore 2 della rianodina (RyR2) (rilascio di calcio indotto dal calcio). La fosforilazione di questi canali aumenta la loro permeabilità al calcio e aumenta la contrattilità dei rispettivi miociti cardiaci.
I farmaci calcioantagonisti di tipo L vengono utilizzati come antiaritmici cardiaci o antipertensivi , a seconda che i farmaci abbiano una maggiore affinità per il cuore (le fenilalchilammine , come il verapamil ), o per i vasi sanguigni (le diidropiridine , come la nifedipina ).
Nel muscolo scheletrico, v'è una concentrazione molto elevata di canali del calcio di tipo L, situata nelle T-tubuli . La depolarizzazione muscolare si traduce in grandi correnti di gating, ma flusso di calcio anormalmente basso, che ora si spiega con l'attivazione molto lenta delle correnti ioniche. Per questo motivo, poco o nessun Ca 2+ passa attraverso la membrana del tubulo T durante un singolo potenziale d'azione.
Storia
Nel 1953, Paul Fatt e Bernard Katz scoprirono i canali del calcio voltaggio dipendenti nel muscolo dei crostacei. I canali hanno mostrato diverse tensioni di attivazione e proprietà di conduzione del calcio e sono stati quindi separati in canali di attivazione ad alta tensione (HVA) e canali di attivazione a bassa tensione (LVA). Dopo ulteriori sperimentazioni, è stato scoperto che i canali HVA si aprirebbero alla 1,4-diidropiridina ( DHP ). Utilizzando DHP, hanno trovato che i canali HVA erano specifici per determinati tessuti e reagito in modo diverso, che ha portato ad un'ulteriore categorizzazione dei canali HVA nel tipo L, tipo P e di tipo N . I canali del calcio di tipo L sono stati sequenziati con peptidi e si è scoperto che c'erano 4 tipi di canali del calcio di tipo L: α 1 S (muscolo scheletrico), α 1 C (cardio), α 1 D (trovato nel cervello) e α 1 F (trovato nella retina). Nel 2000, dopo ulteriori ricerche sulle subunità α 1 nei canali del calcio voltaggio-dipendenti, è stata utilizzata una nuova nomenclatura che ha chiamato i canali del calcio di tipo L CaV1 con le sue subunità chiamate CaV1.1 , Cav1.2 , CaV1.3 e CaV1.4 . La ricerca sulle subunità CaV1 continua a rivelare di più sulla loro struttura, funzione e applicazioni farmaceutiche.
Struttura
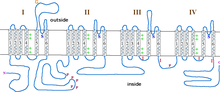
I canali del calcio di tipo L contengono 5 diverse subunità, le subunità α1 (170-240 kDa), α2 (150 kDa), δ (17-25 kDa), β (50-78 kDa) e γ (32 kDa). Le subunità α2, δ e sono legate in modo non covalente alla subunità α1 e modulano il traffico ionico e le proprietà biofisiche della subunità α1. Le subunità α2 e si trovano nello spazio extracellulare mentre le subunità β e si trovano nello spazio citosolico.
La subunità α1 è un eterotetramero che ha quattro regioni transmembrana , note come domini I-IV, che attraversano il plasma sei volte come α-eliche , chiamate S0-S6 (S0 e S1 insieme attraversano la membrana una volta). La subunità α1 nel suo insieme contiene il dominio di rilevamento della tensione, il poro di conduzione e l'apparato di gating. Come la maggior parte dei canali ionici voltaggio-dipendenti , la subunità α è composta da 4 subunità. Ogni subunità è formata da 6 domini alfa-elica, transmembrana che attraversano la membrana (numerati S1-S6). Le subunità S1-S4 costituiscono il sensore di tensione, mentre le subunità S5-S6 costituiscono il filtro di selettività. Per rilevare la tensione della cellula, le eliche S1-S3 contengono molti amminoacidi di amminoacidi caricati negativamente mentre le eliche S4 contengono amminoacidi principalmente caricati positivamente con un anello P che collega le eliche S4 a S5. Dopo i domini S1-6, ci sono sei domini C che consistono in due motivi EF-hand (C1-2 e C3-4) e un dominio Pre-IQ (C5) e un dominio IQ (C6). Ci sono anche due motivi a mano EF sull'N-terminale. Sia il capolinea N che il capolinea C si trovano nello spazio citosolico con il capolinea C che è molto più lungo del capolinea N.
La subunità β è nota per avere quattro isoforme (β1-β4) per regolare le funzioni del canale ed è collegata ad α1 attraverso il linker α1 I e II nel citosol alla tasca di legame α1 (ABP). Ogni isoforma contiene un dominio di omologia 3 src (SH3) e un dominio simile alla guanilato-chinasi (GK) che sono separati da un dominio HOOK e tre regioni non strutturate.
Le subunità α2 e δ sono collegate tra loro da legami disolfuro (a volte noto come subunità α2δ) e interagiscono con α1. hanno quattro isoforme conosciute chiamate da α2δ-1 a α2δ-2 e contengono un dominio von Willebrand A (VWA) e un dominio Cache . La regione α2 si trova nello spazio extracellulare mentre la regione δ si trova nella membrana cellulare e si è visto che è ancorata con un'ancora di glicosilfosfatidilinositolo (GPI).
La subunità γ ha otto isoforme (γ1-γ8) ed è collegata alla subunità α1 ed è stata trovata solo nelle cellule muscolari nei canali CaV1.1 e CaV1.2. Non si sa molto sulla subunità γ, ma è stata collegata alle interazioni nelle forze idrofobiche.
Meccanismo
L'apertura del poro nei canali del calcio di tipo L avviene nella subunità α1. Quando la membrana si depolarizza, l'elica S4 si sposta attraverso i linker S4 e S5 alle estremità citoplasmatiche delle eliche S5 e S6. Questo apre la porta di attivazione che è formata dal lato interno delle eliche S6 nella subunità α1.
Il modo più predominante di autoinibizione dei canali del calcio di tipo L è con il complesso Ca 2+ /Cam. Quando il poro si apre e provoca un afflusso di calcio, il calcio si lega alla calmodulina e quindi interagisce con l'anello che collega i motivi adiacenti della mano EF e provoca un cambiamento conformazionale nel motivo della mano EF in modo che interagisca con il poro per causare una rapida inibizione nel canale. Si discute ancora su dove e come interagiscono il poro e la mano EF. Le tasche idrofobiche nel complesso Ca 2+ /Cam si legheranno anche a tre sezioni del dominio IQ note come "ancore aromatiche". Il complesso Ca 2+ /Cam ha un'elevata affinità verso i canali del calcio di tipo L, permettendogli di bloccarsi anche quando ci sono basse quantità di calcio presenti nella cellula. Il poro alla fine si chiude quando la cellula si ripolarizza e provoca un cambiamento conformazionale nel canale per metterlo nella conformazione chiusa.
Inibizione e modulazione
Una delle caratteristiche più riconosciute del canale del calcio di tipo L è la sua sensibilità unica alle 1,4-diidropiridine (DHP) . A differenza di altri canali del calcio voltaggio dipendenti, i canali del calcio di tipo L sono resistenti ai farmaci inibitori ⍵-CT X (GVIA) e ⍵-AG A (IVA).
Una forma di modulazione ben osservata è dovuta allo splicing alternativo . Una forma comune di modulazione da splicing alternativo è il modulatore C-terminale (CTM). Ha un'α-elica carica positivamente sul C-terminale chiamata DCRD e un'elica carica negativamente subito dopo il motivo IQ (sito di interazione CaM) chiamata PCRD. Le due eliche possono formare una struttura che si lega in modo competitivo con CaM per ridurre la probabilità di stato aperto e abbassare l'inibizione calcio-dipendente (CDI).
Si osserva anche splicing alternativo sulle subunità per creare diverse isoforme per conferire ai canali proprietà diverse a causa della palmitoilazione e dell'editing dell'RNA . Altre forme di modulazione sulla subunità β includono l'aumento o la diminuzione dell'espressione della subunità. Ciò è dovuto al fatto che le subunità β aumentano la probabilità di apertura del canale, l'attività nella membrana plasmatica e antagonizzano l' ubiquitinazione del canale.
I canali del calcio di tipo L sono anche modulati dai recettori accoppiati a proteine G e dal sistema nervoso adrenergico . La proteina chinasi A (PKA) attivata da una cascata di recettori accoppiati a proteine G può fosforilare i canali del calcio di tipo L, dopo che i canali formano un complesso di segnalazione con le proteine di ancoraggio della chinasi A (AKAP) , per aumentare la corrente di calcio attraverso il canale, aumentando la probabilità di stato aperto e un periodo di recupero accelerato. La fosfolipasi C attivata (PLC) dai recettori accoppiati a proteine G può scomporre i polifosfoinositidi per ridurre la corrente di calcio dei canali del 20% -30%.
È stato osservato che il sistema nervoso adrenergico modula i canali del calcio di tipo L scindendo il frammento C-terminale quando il recettore β-adrenergico viene stimolato per aumentare l'attivazione dei canali.
geni
Guarda anche
Riferimenti
Ulteriori letture
- Takahashi K, Hayashi S, Miyajima M, Omori M, Wang J, Kaihara K, et al. (maggio 2019). "Il canale del calcio di tipo L modula la meccanosensibilità della linea cellulare di cardiomiociti H9c2" . Calcio cellulare . 79 : 68-74. doi : 10.1016/j.ceca.2019.02.008 . PMID 30836292 .
Questo articolo incorpora il testo della Biblioteca Nazionale di Medicina degli Stati Uniti , che è di pubblico dominio .
link esterno
- "Canali del calcio voltaggio-dipendenti" . Database IUPHAR di recettori e canali ionici . Unione Internazionale di Farmacologia di Base e Clinica.
- L-Type+Calcium+Channel presso la National Library of Medicine degli Stati Uniti Medical Subject Headings (MeSH)