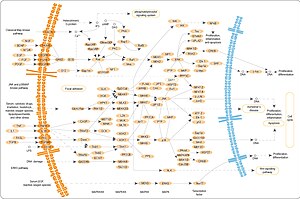
Percorso MAPK/ERK - MAPK/ERK pathway

La via MAPK/ERK (nota anche come via Ras-Raf-MEK-ERK ) è una catena di proteine nella cellula che comunica un segnale da un recettore sulla superficie della cellula al DNA nel nucleo della cellula.
Il segnale inizia quando una molecola di segnalazione si lega al recettore sulla superficie cellulare e termina quando il DNA nel nucleo esprime una proteina e produce qualche cambiamento nella cellula, come la divisione cellulare . Il percorso include molte proteine, tra cui MAPK ( chinasi di proteine attivate da mitogeni , originariamente chiamate ERK, chinasi regolate dal segnale extracellulare ), che comunicano aggiungendo gruppi fosfato a una proteina vicina ( fosforilandola ), che agisce come "on" o " spento".
Quando una delle proteine nel percorso è mutata, può rimanere bloccata nella posizione "on" o "off", che è un passaggio necessario nello sviluppo di molti tumori. I componenti del percorso MAPK/ERK sono stati scoperti quando sono stati trovati nelle cellule tumorali. I farmaci che invertono l'interruttore "on" o "off" vengono studiati come trattamenti contro il cancro.
Sfondo
Nel complesso, il mitogeno extracellulare si lega al recettore di membrana. Ciò consente a Ras (un piccolo GTPase ) di scambiare il suo PIL con un GTP . Ora può attivare MAP3K (es. Raf ), che attiva MAP2K , che attiva MAPK . MAPK ora può attivare un fattore di trascrizione, come Myc . Più in dettaglio:
Attivazione Ras
Le tirosin chinasi legate al recettore come il recettore del fattore di crescita epidermico (EGFR) sono attivate da ligandi extracellulari , come il fattore di crescita epidermico (EGF). Il legame dell'EGF all'EGFR attiva l'attività tirosin-chinasica del dominio citoplasmatico del recettore. L'EGFR viene fosforilato sui residui di tirosina. Le proteine di ancoraggio come GRB2 contengono un dominio SH2 che si lega ai residui di fosfotirosina del recettore attivato. GRB2 si lega al fattore di scambio nucleotidico guanina SOS tramite i due domini SH3 di GRB2. Quando il complesso GRB2-SOS si aggancia all'EGFR fosforilato, SOS si attiva. SOS attivato promuove quindi la rimozione del PIL da un membro della sottofamiglia Ras (in particolare H-Ras o K-Ras ). Ras può quindi associare GTP e diventare attivo.
Oltre a EGFR, altri recettori della superficie cellulare che possono attivare questa via tramite GRB2 includono Trk A/B , recettore del fattore di crescita dei fibroblasti (FGFR) e PDGFR .
Cascata di chinasi
Ras attivato attiva l'attività della proteina chinasi della chinasi RAF . RAF chinasi fosforila e attiva MEK (MEK1 e MEK2). MEK fosforila e attiva una proteina chinasi attivata da mitogeni (MAPK).
RAF ed ERK (noto anche come MAPK) sono entrambi protein chinasi serina/treonina-selettive . MEK è una serina/tirosina/treonina chinasi.
In senso tecnico, RAF, MEK e MAPK sono tutte chinasi attivate da mitogeni, così come MNK (vedi sotto). MAPK era originariamente chiamato " chinasi segnale-regolata extracellulare " ( ERK ) e "chinasi proteica associata ai microtubuli" (MAPK). Una delle prime proteine note per essere fosforilate da ERK era una proteina associata ai microtubuli (MAP). Come discusso di seguito, sono stati successivamente trovati molti bersagli aggiuntivi per la fosforilazione da parte di MAPK e la proteina è stata ribattezzata "chinasi di proteina attivata da mitogeni" (MAPK). La serie di chinasi da RAF a MEK a MAPK è un esempio di cascata di protein chinasi. Tali serie di chinasi forniscono opportunità per la regolazione del feedback e l'amplificazione del segnale.
Regolamento di traduzione e trascrizione
Tre delle molte proteine che sono fosforilate da MAPK sono mostrate nella figura. Un effetto di attivazione di MAPK è di alterare la traduzione di mRNA per le proteine. MAPK fosforila la proteina ribosomiale S6 chinasi 40S ( RSK ). Questo attiva RSK, che, a sua volta, fosforila la proteina ribosomiale S6. Le protein chinasi attivate da mitogeni che fosforilano la proteina ribosomiale S6 sono state le prime ad essere isolate.
MAPK regola le attività di diversi fattori di trascrizione . MAPK può fosforilare C-myc . MAPK fosforila e attiva MNK, che, a sua volta, fosforila CREB . MAPK regola anche la trascrizione del gene C-Fos . Alterando i livelli e le attività dei fattori di trascrizione, MAPK porta alla trascrizione alterata di geni importanti per il ciclo cellulare .
I geni 22q11, 1q42 e 19p13 sono associati a schizofrenia , schizoaffettivo , bipolare ed emicrania influenzando la via ERK.
Regolazione dell'ingresso e della proliferazione nel ciclo cellulare
Ruolo della segnalazione mitogena nella progressione del ciclo cellulare La via ERK svolge un ruolo importante nell'integrazione di segnali esterni dalla presenza di mitogeni come il fattore di crescita epidermico (EGF) in eventi di segnalazione che promuovono la crescita e la proliferazione cellulare in molti tipi di cellule di mammifero. In un modello semplificato, la presenza di mitogeni e fattori di crescita innesca l'attivazione di recettori tirosin chinasi canonici come EGFR portando alla loro dimerizzazione e successiva attivazione della piccola GTPasi Ras. Questo porta quindi a una serie di eventi di fosforilazione a valle nella cascata MAPK (Raf-MEK-ERK) che alla fine portano alla fosforilazione e all'attivazione di ERK. La fosforilazione di ERK determina un'attivazione della sua attività chinasica e porta alla fosforilazione dei suoi numerosi bersagli a valle coinvolti nella regolazione della proliferazione cellulare. Nella maggior parte delle cellule, è necessaria una qualche forma di attività ERK sostenuta affinché le cellule attivino i geni che inducono l'ingresso nel ciclo cellulare e sopprimono i regolatori negativi del ciclo cellulare. Due di questi obiettivi importanti includono i complessi della ciclina D con Cdk4 e Cdk6 (Cdk4/6) che sono entrambi fosforilati da ERK. La transizione dalla fase G1 alla fase S è coordinata dall'attività della ciclina D-Cdk4/6, che aumenta durante la fase G1 tardiva mentre le cellule si preparano ad entrare nella fase S in risposta ai mitogeni. L'attivazione di Cdk4/6 contribuisce all'iperfosforilazione e alla successiva destabilizzazione della proteina del retinoblastoma (Rb). Rb ipofosforilato, è normalmente legato al fattore di trascrizione E2F all'inizio di G1 e ne inibisce l'attività trascrizionale, prevenendo l'espressione dei geni di ingresso della fase S tra cui Cyclin E, Cyclin A2 ed Emi1. L'attivazione di ERK1/2 a valle della segnalazione Ras indotta dal mitogeno è necessaria e sufficiente per rimuovere questo blocco del ciclo cellulare e consentire alle cellule di progredire verso la fase S nella maggior parte delle cellule di mammifero.
Controllo della retroazione a valle e generazione di un interruttore G1/S bistabile
Il punto di restrizione (punto R) segna l'evento critico quando una cellula di mammifero si impegna a proliferare e diventa indipendente dalla stimolazione della crescita. È fondamentale per la normale differenziazione e l'omeostasi dei tessuti e sembra essere disregolato praticamente in tutti i tumori. Sebbene il punto R sia stato collegato a varie attività coinvolte nella regolazione della transizione G1-S del ciclo cellulare dei mammiferi, il meccanismo sottostante rimane poco chiaro. Usando misurazioni a cellula singola, Yao et al., Mostra che il percorso Rb-E2F funziona come un interruttore bistabile per convertire gli input di siero graduati in risposte E2F tutte o nessuna.
I segnali di crescita e mitogeno vengono trasmessi a valle del percorso ERK sono incorporati in più circuiti di feedback positivi per generare un interruttore bistabile a livello di attivazione E2F. Ciò si verifica a causa di tre interazioni principali durante la fase G1 tardiva. Il primo è il risultato della stimolazione del mitogeno attraverso l'ERK che porta all'espressione del fattore di trascrizione Myc, che è un attivatore diretto di E2F. La seconda via è il risultato dell'attivazione di ERK che porta all'accumulo di complessi attivi di Cyclin D e Cdk4/6 che destabilizzano Rb tramite fosforilazione e servono inoltre ad attivare E2F e promuovere l'espressione dei suoi bersagli. Infine, queste interazioni sono tutte rafforzate da un ulteriore ciclo di feedback positivo di E2F su se stesso, poiché la sua stessa espressione porta alla produzione del complesso attivo di Cyclin E e CDK2, che serve ulteriormente a bloccare la decisione di una cellula di entrare in fase S. Di conseguenza, quando la concentrazione sierica viene aumentata in modo graduale, la maggior parte delle cellule di mammifero risponde in modo simile a un interruttore entrando nella fase S. Questo interruttore E2F bistabile e stimolato dal mitogeno mostra isteresi, poiché le cellule sono inibite dal ritorno a G1 anche dopo il ritiro del mitogeno dopo l'attivazione di E2F.
Elaborazione dinamica del segnale da parte della via ERK
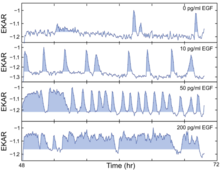
La via EGFR-ERK/MARK (chinasi regolata dal fattore di crescita epidermico extracellulare-regolato dalla proteina chinasi attivata da mitogeni) stimolata dall'EGF è fondamentale per la proliferazione cellulare, ma la separazione temporale tra segnale e risposta oscura il segnale -relazione di risposta in ricerche precedenti. Nel 2013, Albeck et al. fornito prove sperimentali chiave per colmare questa lacuna di conoscenza. Hanno misurato la forza e la dinamica del segnale con la stimolazione EGF allo stato stazionario, in cui la segnalazione e l'uscita possono essere facilmente correlate. Hanno inoltre mappato la relazione segnale-risposta attraverso l'intera gamma dinamica del percorso. Utilizzando il rilevamento dell'immunofluorescenza ad alto contenuto (HCIF) di ERK fosforilato (pERK) e biosensori FRET a cellule vive, hanno monitorato l'output a valle del percorso ERK sia nelle cellule vive che nelle cellule fisse. Per collegare ulteriormente le caratteristiche quantitative della segnalazione ERK ai tassi di proliferazione, hanno stabilito una serie di condizioni di stato stazionario utilizzando una gamma di concentrazioni di EGF applicando EGF con concentrazioni diverse.
Esperimenti di imaging a cellula singola hanno mostrato che ERK è attivato in raffiche stocastiche in presenza di EGF. Inoltre, è stato dimostrato che il percorso codifica la forza degli input di segnalazione tramite impulsi modulati in frequenza della sua attività. Utilizzando biosensori FRET a cellule vive, le cellule hanno indotto con differenti concentrazioni di EGF burst di attività illecita di diversa frequenza, dove livelli più elevati di EGF hanno portato a burst più frequenti di attività ERK. Per capire come l'ingresso nella fase S può essere influenzato da impulsi sporadici di attività ERK a basse concentrazioni di EGF, hanno utilizzato cellule MCF-10A che esprimono EKAR-EV e RFP-geminina e hanno identificato gli impulsi dell'attività ERK con il punteggio e quindi allineato questo profilo di attività ERK con il tempo di induzione della GFP-geminina. Hanno scoperto che periodi più lunghi di attività ERK stimolano l'ingresso nella fase S, come suggerito dall'aumento della lunghezza dell'impulso. Per comprendere le dinamiche della via EGFR-ERK, in particolare come viene modulata la frequenza e l'ampiezza, hanno applicato l'inibitore EGFR gefitinib o l'inibitore altamente selettivo della chinasi MAPK/ERK (MEK) PD0325901 (PD). Due inibitori danno effettivamente risultati leggermente diversi: gefitinib, a concentrazione intermedia, indurrebbe un comportamento pulsatorio e anche uno spostamento bimodale, che non si osserva con il PD. Combinano ulteriormente EGF e PD insieme e traggono la conclusione che la frequenza delle attività ERK è modulata dalla variazione quantitativa mentre l'ampiezza è modulata dal cambiamento dell'attività MEK. Infine si sono rivolti a Fra-1, uno degli effettori a valle del percorso ERK, poiché è tecnicamente difficile stimare direttamente le attività di ERK. Per capire come l'output del percorso ERK integrato (che dovrebbe essere indipendente dalla frequenza o dall'ampiezza) influenza il tasso di proliferazione, hanno usato la combinazione di un'ampia gamma di concentrazioni di EGF e PD e hanno scoperto che esiste effettivamente una singola forma a "L" invertita curvilinea relazione, che suggerisce che a bassi livelli di uscita del percorso ERK, piccoli cambiamenti nell'intensità del segnale corrispondono a grandi cambiamenti nel tasso di proliferazione, mentre grandi cambiamenti nell'intensità del segnale vicino alla fascia alta della gamma dinamica hanno un impatto minimo sulla proliferazione. La fluttuazione della segnalazione ERK evidenzia potenziali problemi con gli attuali approcci terapeutici, fornendo una nuova prospettiva in termini di pensiero sul targeting dei farmaci nel percorso ERK nel cancro.
Integrazione di mitogeni e segnali di stress nella proliferazione
Recenti esperimenti di imaging di cellule vive nelle cellule MCF10A e MCF7 hanno dimostrato che una combinazione di segnalazione del mitogeno tramite ERK e segnali di stress attraverso l'attivazione di p53 nelle cellule madri contribuisce alla probabilità che le cellule figlie appena formate rientrino immediatamente nel ciclo cellulare o entrino quiescenza (G0) che precede la mitosi. Piuttosto che le cellule figlie che iniziano senza proteine di segnalazione chiave dopo la divisione, l'mRNA della ciclina D1 indotta dal mitogeno/ERK e la proteina p53 indotta dal danno al DNA, entrambi fattori di lunga durata nelle cellule, possono essere ereditate stabilmente dalle cellule madri dopo la divisione cellulare. I livelli di questi regolatori variano da cellula a cellula dopo la mitosi e la stechiometria tra di loro influenza fortemente l'impegno del ciclo cellulare attraverso l'attivazione di Cdk2. Le perturbazioni chimiche che utilizzano inibitori della segnalazione ERK o induttori della segnalazione p53 nelle cellule madri suggeriscono che le cellule figlie con alti livelli di proteina p53 e bassi livelli di trascritti di ciclina D1 hanno mostrato di entrare principalmente in G0 mentre le cellule con alti livelli di ciclina D1 e bassi livelli di p53 sono più probabili per rientrare nel ciclo cellulare. Questi risultati illustrano una forma di memoria molecolare codificata attraverso la storia della segnalazione del mitogeno attraverso ERK e della risposta allo stress attraverso p53.
Significato clinico
La crescita incontrollata è un passo necessario per lo sviluppo di tutti i tumori. In molti tumori (ad esempio il melanoma ), un difetto nel percorso MAP/ERK porta a quella crescita incontrollata. Molti composti possono inibire i passaggi della via MAP/ERK, e quindi sono potenziali farmaci per il trattamento del cancro, ad esempio il morbo di Hodgkin .
Il primo farmaco autorizzato ad agire su questa via è il sorafenib , un inibitore della chinasi Raf .
Altri inibitori Raf: SB590885, PLX4720, XL281, RAF265, encorafenib , dabrafenib , vemurafenib .
Alcuni inibitori di MEK : cobimetinib , CI-1040, PD0325901, Binimetinib ( MEK162 ), selumetinib , Trametinib (GSK1120212) È stato scoperto che la moxibustione dei punti di agopuntura ha un ruolo nell'alleviare il danno della mucosa gastrica indotto dall'alcol in un modello murino, che può essere strettamente associato ai suoi effetti nell'attività di up-regolazione della via di trasduzione del segnale del fattore di crescita epidermico/ERK.
Il percorso RAF-ERK è anche coinvolto nella fisiopatologia della sindrome di Noonan , una malattia polimalformativa, in cui la simvastatina è stata proposta come un modo per migliorare i sintomi cognitivi del SNC del disturbo.
L' analisi del microarray proteico può essere utilizzata per rilevare sottili cambiamenti nell'attività proteica nelle vie di segnalazione. Le sindromi dello sviluppo causate da mutazioni germinali nei geni che alterano i componenti RAS della via di trasduzione del segnale MAP/ERK sono chiamate RASopatie .
Guarda anche
- Janus chinasi
- fosfatasi
- Proteina adattatrice per la trasduzione del segnale
- Recettore accoppiato a proteine G
Riferimenti
link esterno
- MAP chinasi risorsa .
- Enciclopedia dei geni e dei genomi di Kyoto - percorso MAPK
- MAP + chinasi + sistema di segnalazione + presso la Biblioteca nazionale statunitense di medicina Intestazioni di soggetti medici (MeSH)