Microsporidi - Microsporidia
| Microsporidi | |
|---|---|

|
|
|
Sporoblasto di Fibrillanosema crangonicis |
|
|
Classificazione scientifica |
|
| (non classificato): | Unikonta |
| (non classificato): | Obazoa |
| (non classificato): | Opistoconta |
| (non classificato): | Holomycota |
| (non classificato): | zoosporia |
| (non classificato): | Opistosporidia |
| Divisione: |
Microsporidi Balbiani, 1882 |
| Classi e ordini | |
| Sinonimi | |
|
|
Microsporidia sono un gruppo di spora -forming unicellulari parassiti . Una volta erano considerati protozoi o protisti , ma ora sono noti per essere funghi o un gruppo gemello dei funghi. Recentemente è stato scoperto che infettano i coleotteri su larga scala, in uno studio Cornell del 2017. Vengono nominati liberamente 1500 dei probabilmente più di un milione di specie. I microsporidi sono limitati agli ospiti animali e tutti i principali gruppi di animali ospitano i microsporidi. La maggior parte infetta gli insetti , ma sono anche responsabili di comuni malattie dei crostacei e dei pesci . Le specie nominate di microsporidi di solito infettano una specie ospite o un gruppo di taxa strettamente correlati. Circa il 10% delle specie sono parassiti dei vertebrati, diverse specie, la maggior parte delle quali sono opportuniste, possono infettare gli esseri umani, nei quali possono causare microsporidiosi .
Dopo l'infezione influenzano i loro ospiti in vari modi e tutti gli organi ei tessuti sono invasi, sebbene generalmente da diverse specie di microsporidi. Alcune specie sono letali e alcune sono utilizzate nel controllo biologico degli insetti nocivi. La castrazione parassitaria , il gigantismo o il cambiamento del sesso dell'ospite sono tutti potenziali effetti del parassitismo microsporidiano (negli insetti). Nei casi più avanzati di parassitismo il microsporidio governa completamente la cellula ospite e ne controlla il metabolismo e la riproduzione, formando uno xenoma .
La replicazione avviene all'interno delle cellule dell'ospite, che vengono infettate per mezzo di spore unicellulari . Questi variano da 1 a 40 μm, rendendoli alcuni degli eucarioti più piccoli . I microsporidi che infettano i mammiferi sono 1,0-4,0 μm. Hanno anche i genomi eucariotici più piccoli .
I termini "microsporidi" (pl. "microsporidi") e "microsporidi" sono usati come nomi vernacolari per i membri del gruppo. Il nome Microsporidium Balbiani, 1884 è anche usato come genere catchall per i membri di incertae sedis .
Morfologia
I microsporidi mancano di mitocondri , invece possiedono mitosomi . Mancano anche di strutture mobili, come i flagelli .
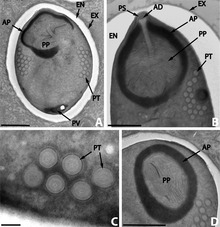
I microsporidi producono spore altamente resistenti, in grado di sopravvivere al di fuori del loro ospite fino a diversi anni. La morfologia delle spore è utile per distinguere tra specie diverse. Le spore della maggior parte delle specie sono ovali o piriformi, ma le spore a forma di bastoncino o sferiche non sono insolite. Alcuni generi producono spore di forma unica per il genere.
La spora è protetta da un muro, costituito da tre strati:
- un'esospore esterna densa di elettroni
- un'endospora mediana, ampia e apparentemente senza struttura , contenente chitina
- una sottile membrana plasmatica interna
Nella maggior parte dei casi ci sono due nuclei strettamente associati , che formano un diplokaryon , ma a volte ce n'è solo uno.
La metà anteriore della spora contiene un apparato simile ad un arpione con un lungo filamento polare filiforme , che è arrotolato nella metà posteriore della spora. La parte anteriore del filamento polare è circondata da un polaroplasto , una lamella di membrane. Dietro il filamento polare, c'è un vacuolo posteriore .
Infezione
Nell'intestino dell'ospite la spora germina, accumula pressione osmotica fino a quando la sua parete rigida si rompe nel suo punto più sottile all'apice. Il vacuolo posteriore si gonfia, costringendo il filamento polare a espellere rapidamente il contenuto infettivo nel citoplasma del potenziale ospite. Contemporaneamente il materiale del filamento viene riorganizzato per formare un tubo che funge da ago ipodermico e penetra nell'epitelio intestinale.
Una volta all'interno della cellula ospite, uno sporoplasma cresce, dividendosi o formando un plasmodio multinucleato , prima di produrre nuove spore. Il ciclo di vita varia notevolmente. Alcuni hanno un semplice ciclo di vita asessuata , mentre altri hanno un ciclo di vita complesso che coinvolge più ospiti e la riproduzione sia asessuata che sessuale . Diversi tipi di spore possono essere prodotti in fasi diverse, probabilmente con funzioni diverse tra cui l' autoinfezione (trasmissione all'interno di un singolo ospite).
Implicazioni mediche
Negli animali e nell'uomo, i microsporidi spesso causano malattie croniche e debilitanti piuttosto che infezioni letali. Gli effetti sull'ospite includono la riduzione della longevità, della fertilità, del peso e del vigore generale. La trasmissione verticale dei microsporidi è frequentemente segnalata.
Nel caso degli ospiti di insetti, la trasmissione verticale si verifica spesso come trasmissione transovarica , in cui i parassiti microsporidi passano dalle ovaie dell'ospite femminile nelle uova e alla fine si moltiplicano nelle larve infette. Amblyospora salinaria n. sp. che infetta la zanzara Culex salinarius Coquillett, e Amblyospora californica che infetta la zanzara Culex tarsalis Coquillett, forniscono esempi tipici di trasmissione transovariale dei microsporidi. I microsporidi, in particolare la Vavraia culicis , che infetta le zanzare , vengono esplorati come un possibile metodo di controllo della malaria "a prova di evoluzione". L'infezione da microsporidi di Anopheles gambiae (il principale vettore della malaria da Plasmodium falciparum ) riduce l'infezione malarica all'interno della zanzara e accorcia la durata della vita della zanzara. Poiché la maggior parte delle zanzare infette dalla malaria muore naturalmente prima che il parassita della malaria sia sufficientemente maturo per la trasmissione, qualsiasi aumento della mortalità delle zanzare attraverso l'infezione da microsporidi può ridurre la trasmissione della malaria all'uomo. Nel maggio 2020, i ricercatori hanno riferito che Microsporidia MB , un simbionte nell'intestino medio e nelle ovaie di An. arabiensis , trasmissione significativamente ridotta di P. falciparum , non ha avuto "nessun effetto manifesto" sull'idoneità delle zanzare ospiti ed è stata trasmessa verticalmente (tramite ereditarietà).
Clinico
Le infezioni da microsporidi nell'uomo a volte causano una malattia chiamata microsporidiosi . Almeno 14 specie di microsporidi, distribuite in otto generi, sono state riconosciute come patogeni umani . Questi includono Trachipleistophora hominis .
Come iperparassiti
I microsporidi possono infettare una varietà di ospiti, compresi gli ospiti che sono essi stessi parassiti. In tal caso la specie microsporidiana è un iperparassita , cioè un parassita di un parassita. A titolo di esempio, più di diciotto specie sono noti parassitizzano digenei (parassitarie vermi piatti ). Questi digenei sono essi stessi parassiti in vari vertebrati e molluschi . Otto di queste specie appartengono al genere Nosema .
genomi
I microsporidi hanno il più piccolo genoma eucariotico (nucleare) conosciuto . Lo stile di vita parassitario dei microsporidi ha portato alla perdita di molti geni mitocondriali e del Golgi , e anche i loro RNA ribosomiali sono di dimensioni ridotte rispetto a quelli della maggior parte degli eucarioti . Di conseguenza, i genomi dei microsporidi sono molto più piccoli di quelli degli altri eucarioti. I genomi microsporidiali attualmente conosciuti hanno una dimensione compresa tra 2,5 e 11,6 Mb, e codificano da 1.848 a 3.266 proteine che si trovano nello stesso intervallo di molti batteri .
Il trasferimento genico orizzontale (HGT) sembra essersi verificato molte volte nei microsporidi. Ad esempio, i genomi di Encephalitozoon romaleae e Trachipleistophora hominis contengono geni che derivano da animali e batteri, e alcuni anche da funghi.
Classificazione
Il primo genere di microsporidi descritto, Nosema , è stato inizialmente inserito da Nägeli nel gruppo fungino Schizomycetes insieme ad alcuni batteri e lieviti . Per qualche tempo i microsporidi sono stati considerati eucarioti molto primitivi, collocati nel gruppo dei protozoi Cnidospora . Successivamente, soprattutto a causa della mancanza di mitocondri, sono stati messi insieme con l'altro protozoi come diplomonadida , parabasalids e archiamebe del protozoo -group Archezoa . Ricerche più recenti hanno falsificato questa teoria di origine precoce (per tutte queste). Invece, i microsporidi vengono proposti come organismi altamente sviluppati e specializzati, che si limitano a dispensare funzioni che non sono più necessarie, perché fornite dall'ospite. Inoltre, gli organismi sporigeni in generale hanno un complesso sistema di riproduzione, sia sessuale che asessuata, che sembra tutt'altro che primitivo.
Dalla metà degli anni 2000 i microsporidi sono collocati all'interno dei Funghi o come gruppo gemello dei Funghi con un antenato comune.
Il lavoro per identificare i cladi si basa in gran parte sull'habitat e sull'ospite. Tre classi di Microsporidia sono proposte da Vossbrinck e Debrunner-Vossbrinck, in base all'habitat: Aquasporidia, Marinosporidia e Terresporidia.
Una seconda classificazione di Cavalier-Smith 1993:
- Subphyla Rudimicrospora Cavalier-Smith 1993
- Classe Minisporea Cavalier-Smith 1993
- Ordine Minisporida Sprague, 1972
- Classe Metchnikovellea Weiser, 1977
- Ordine Metchnikovellida Vivier, 1975
- Classe Minisporea Cavalier-Smith 1993
- Subphyla Polaroplasta Cavalier-Smith 1993
- Classe Pleistophoridea Cavalier-Smith 1993
- Ordine Pleistophorida Stempell 1906
- Classe Disporea Cavalier-Smith 1993
- Sottoclasse Unikariotia Cavalier-Smith 1993
- Sottoclasse Diplokaryotia Cavalier-Smith 1993
- Classe Pleistophoridea Cavalier-Smith 1993
|
Guarda anche
- Elenco dei generi Microsporidi
- Glugea , un genere di microsporidi
- Nosema apis , un parassita microsporidiano delle api
Riferimenti
link esterno
![]() Dati relativi ai Microsporidi su Wikispecies
Dati relativi ai Microsporidi su Wikispecies
- BioHealthBase Bioinformatics Resource Center Database di sequenze di microspordi e informazioni correlate.
- Microsporidi presso la National Library of Medicine degli Stati Uniti Medical Subject Headings (MeSH)
| Wikimedia Commons ha media relativi a Microsporidia . |


