Plutonio -Plutonium
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Plutonio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronuncia |
/ p l uː ˈ t oʊ n i ə m / ( ploo- TOH -nee-əm ) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allotropi | vedi Allotropi del plutonio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | bianco argenteo, appannamento al grigio scuro in aria | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero di Massa | [244] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Plutonio nella tavola periodica | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero atomico ( Z ) | 94 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo | gruppi f-block (nessun numero) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periodo | periodo 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloccare | blocco f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [ Rn ] 5f 6 7s 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettroni per shell | 2, 8, 18, 32, 24, 8, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase a STP | solido | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 912,5 K (639,4 °C, 1182,9 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 3505 K (3228 °C, 5842 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità (vicino a rt ) | 19,85 g/cm 3 ( 239 Pu) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| quando liquido (a mp ) | 16,63 g/cm 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 2,82kJ /mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di vaporizzazione | 333,5kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacità termica molare | 35,5 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Pressione del vapore
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | +2, +3, +4 , +5, +6, +7, +8 (un ossido anfotero ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | Scala di Pauling: 1,28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energie di ionizzazione | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico | empirico: 159 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 187 ± 13:00 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Righe spettrali del plutonio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Evento naturale | dal decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura di cristallo | monoclino | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 2260 m/sec | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatazione termica | 46,7 µm/(m⋅K) (a 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conduttività termica | 6,74 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistività elettrica | 1.460 µΩ⋅m (a 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordinamento magnetico | paramagnetico | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulo di Young | 96 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Modulo di taglio | 43 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rapporto di Poisson | 0.21 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | 7440-07-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Storia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Denominazione | dal pianeta nano Plutone , a sua volta chiamato dal dio classico degli inferi Plutone | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Scoperta | Glenn T. Seaborg , Arthur Wahl , Joseph W. Kennedy , Edwin McMillan (1940-1941) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Principali isotopi del plutonio | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Il plutonio è un elemento chimico radioattivo con il simbolo Pu e il numero atomico 94. È un metallo attinide di aspetto grigio-argenteo che si appanna se esposto all'aria e forma un rivestimento opaco quando ossidato . L'elemento mostra normalmente sei allotropi e quattro stati di ossidazione . Reagisce con carbonio , alogeni , azoto , silicio e idrogeno . Se esposto all'aria umida, forma ossidi e idruri che possono espandere il campione fino al 70% in volume, che a sua volta si sfalda come una polvere piroforica . È radioattivo e può accumularsi nelle ossa , il che rende pericolosa la manipolazione del plutonio.
Il plutonio fu prodotto sinteticamente e isolato per la prima volta tra la fine del 1940 e l'inizio del 1941, da un bombardamento di deuterone dell'uranio-238 nel ciclotrone da 1,5 metri (60 pollici) presso l' Università della California, Berkeley . In primo luogo, è stato sintetizzato il nettunio-238 ( emivita 2,1 giorni), che successivamente è decaduto beta per formare il nuovo elemento con numero atomico 94 e peso atomico 238 (emivita 88 anni). Poiché l'uranio aveva preso il nome dal pianeta Urano e il nettunio dal pianeta Nettuno , l'elemento 94 prese il nome da Plutone , che all'epoca era considerato anche un pianeta. La segretezza in tempo di guerra ha impedito al team dell'Università della California di pubblicare la sua scoperta fino al 1948.
Il plutonio è l'elemento con il più alto numero atomico presente in natura. Quantità di tracce sorgono nei depositi naturali di uranio-238 quando l'uranio-238 cattura i neutroni emessi dal decadimento di altri atomi di uranio-238.
Sia il plutonio-239 che il plutonio-241 sono fissili , il che significa che possono sostenere una reazione a catena nucleare , portando ad applicazioni in armi nucleari e reattori nucleari . Il plutonio-240 mostra un alto tasso di fissione spontanea , aumentando il flusso di neutroni di qualsiasi campione che lo contenga. La presenza di plutonio-240 limita l'utilizzabilità di un campione di plutonio per le armi o la sua qualità come combustibile per reattori e la percentuale di plutonio-240 ne determina il grado ( grado per armi , grado di combustibile o grado di reattore). Il plutonio-238 ha un tempo di dimezzamento di 87,7 anni ed emette particelle alfa . È una fonte di calore nei generatori termoelettrici di radioisotopi , che vengono utilizzati per alimentare alcuni veicoli spaziali . Gli isotopi di plutonio sono costosi e scomodi da separare, quindi isotopi particolari vengono solitamente prodotti in reattori specializzati.
La produzione di plutonio in quantità utili per la prima volta è stata una parte importante del Progetto Manhattan durante la seconda guerra mondiale che ha sviluppato le prime bombe atomiche. Le bombe Fat Man utilizzate nel test nucleare Trinity nel luglio 1945 e nel bombardamento di Nagasaki nell'agosto 1945 avevano nuclei di plutonio . Gli esperimenti sulle radiazioni umane che studiavano il plutonio sono stati condotti senza consenso informato e diversi incidenti critici , alcuni letali, si sono verificati dopo la guerra. Lo smaltimento dei rifiuti di plutonio dalle centrali nucleari e dalle armi nucleari smantellate costruite durante la Guerra Fredda è una preoccupazione ambientale e di proliferazione nucleare . Altre fonti di plutonio nell'ambiente sono le ricadute di numerosi test nucleari fuori terra, ora vietati .
Caratteristiche
Proprietà fisiche
Il plutonio, come la maggior parte dei metalli, ha inizialmente un aspetto argenteo brillante, molto simile al nichel , ma si ossida molto rapidamente in un grigio opaco, sebbene siano segnalati anche giallo e verde oliva. A temperatura ambiente il plutonio è nella sua forma α ( alfa ) . Questa, la forma strutturale più comune dell'elemento ( allotropo ), è dura e fragile quanto la ghisa grigia a meno che non sia legata con altri metalli per renderla morbida e duttile. A differenza della maggior parte dei metalli, non è un buon conduttore di calore o elettricità . Ha un punto di fusione basso (640 °C, 1.184 °F) e un punto di ebollizione insolitamente alto (3.228 °C, 5.842 °F). Ciò fornisce un ampio intervallo di temperature (oltre 2.500 kelvin) a cui il plutonio è liquido, ma questo intervallo non è né il più grande tra tutti gli attinidi né tra tutti i metalli. Il basso punto di fusione e la reattività del metallo nativo rispetto all'ossido fanno sì che gli ossidi di plutonio siano una forma preferita per applicazioni come il combustibile per reattori a fissione nucleare ( combustibile MOX ).
Il decadimento alfa , il rilascio di un nucleo di elio ad alta energia , è la forma più comune di decadimento radioattivo del plutonio. Una massa di 5 kg di 239 Pu contiene circa12,5 × 10 24 atomi. Con un tempo di dimezzamento di 24.100 anni, circa11,5 × 10 12 dei suoi atomi decadono ogni secondo emettendo una particella alfa da 5,157 MeV . Ciò equivale a 9,68 watt di potenza. Il calore prodotto dalla decelerazione di queste particelle alfa lo rende caldo al tatto.238
Pu a causa della sua emivita molto più breve si riscalda fino a temperature molto più elevate e si illumina di rosso con la radiazione del corpo nero se lasciato senza riscaldamento o raffreddamento esterno. Questo calore è stato utilizzato nei generatori termoelettrici a radioisotopi (vedi sotto).
La resistività è una misura di quanto fortemente un materiale si oppone al flusso di corrente elettrica . La resistività del plutonio a temperatura ambiente è molto alta per un metallo, e diventa ancora più alta con temperature più basse, il che è insolito per i metalli. Questa tendenza continua fino a 100 K , al di sotto del quale la resistività diminuisce rapidamente per i campioni freschi. La resistività inizia quindi ad aumentare con il tempo a circa 20 K a causa del danno da radiazioni, con la velocità dettata dalla composizione isotopica del campione.
A causa dell'autoirradiazione, un campione di plutonio si affatica in tutta la sua struttura cristallina, il che significa che la disposizione ordinata dei suoi atomi viene interrotta dalla radiazione nel tempo. L'autoirradiazione può anche portare alla ricottura che contrasta alcuni degli effetti della fatica quando la temperatura aumenta oltre i 100 K.
A differenza della maggior parte dei materiali, il plutonio aumenta di densità quando si scioglie, del 2,5%, ma il metallo liquido mostra una diminuzione lineare della densità con la temperatura. Vicino al punto di fusione, il plutonio liquido ha una viscosità e una tensione superficiale molto elevate rispetto ad altri metalli.
Allotropi
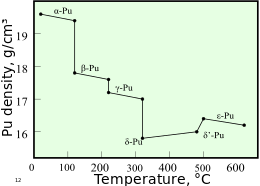
Il plutonio ha normalmente sei allotropi e forma un settimo (zeta, ζ) ad alta temperatura entro un intervallo di pressione limitato. Questi allotropi, che sono diverse modifiche strutturali o forme di un elemento, hanno energie interne molto simili ma densità e strutture cristalline significativamente variabili . Ciò rende il plutonio molto sensibile ai cambiamenti di temperatura, pressione o chimica e consente notevoli cambiamenti di volume in seguito alle transizioni di fase da una forma allotropica a un'altra. Le densità dei diversi allotropi variano da 16,00 g/cm 3 a 19,86 g/cm 3 .
La presenza di questi numerosi allotropi rende molto difficile la lavorazione del plutonio, poiché cambia stato molto rapidamente. Ad esempio, la forma α esiste a temperatura ambiente nel plutonio non legato. Ha caratteristiche di lavorazione simili alla ghisa ma cambia nella forma plastica e malleabile β ( beta ) a temperature leggermente superiori. Le ragioni del complicato diagramma di fase non sono del tutto comprese. La forma α ha una struttura monoclina a bassa simmetria , da qui la sua fragilità, resistenza, compressibilità e scarsa conduttività termica.
Il plutonio nella forma δ ( delta ) esiste normalmente nell'intervallo da 310 °C a 452 °C, ma è stabile a temperatura ambiente se legato con una piccola percentuale di gallio , alluminio o cerio , migliorandone la lavorabilità e consentendone la saldatura . La forma δ ha un carattere metallico più tipico ed è più o meno forte e malleabile come l'alluminio. Nelle armi a fissione, le onde d'urto esplosive utilizzate per comprimere un nucleo di plutonio causeranno anche una transizione dal solito plutonio di fase δ alla forma α più densa, contribuendo in modo significativo a raggiungere la supercriticità . La fase ε, l'allotropo solido a più alta temperatura, mostra un'autodiffusione atomica anomala rispetto ad altri elementi.
Fissione nucleare

Il plutonio è un metallo attinide radioattivo il cui isotopo , plutonio-239 , è uno dei tre isotopi fissili primari ( uranio-233 e uranio-235 sono gli altri due); il plutonio-241 è anche altamente fissile. Per essere considerato fissile, il nucleo atomico di un isotopo deve essere in grado di rompersi o fissiarsi quando viene colpito da un neutrone che si muove lentamente e di rilasciare abbastanza neutroni aggiuntivi per sostenere la reazione a catena nucleare scindendo ulteriori nuclei.
Il plutonio puro-239 può avere un fattore di moltiplicazione (k eff ) maggiore di uno, il che significa che se il metallo è presente in quantità sufficiente e con una geometria appropriata (ad esempio una sfera di dimensioni sufficienti), può formare una massa critica . Durante la fissione, una frazione dell'energia di legame nucleare , che tiene insieme un nucleo, viene rilasciata sotto forma di una grande quantità di energia elettromagnetica e cinetica (gran parte di quest'ultima viene rapidamente convertita in energia termica). La fissione di un chilogrammo di plutonio-239 può produrre un'esplosione equivalente a 21.000 tonnellate di tritolo (88.000 GJ ). È questa energia che rende il plutonio-239 utile nelle armi nucleari e nei reattori .
La presenza dell'isotopo plutonio-240 in un campione limita il suo potenziale di bomba nucleare, poiché il plutonio-240 ha una velocità di fissione spontanea relativamente alta (~ 440 fissioni al secondo per grammo, oltre 1.000 neutroni al secondo per grammo), aumentando il neutrone di fondo livelli e aumentando così il rischio di predetonazione . Il plutonio è identificato come per armi , per combustibili o per reattori in base alla percentuale di plutonio-240 che contiene. Il plutonio per armi contiene meno del 7% di plutonio-240. Il plutonio di grado combustibile contiene dal 7% a meno del 19% e il grado di reattore di potenza contiene il 19% o più di plutonio-240. Il plutonio supergrado , con meno del 4% di plutonio-240, viene utilizzato nelle armi della Marina degli Stati Uniti immagazzinate in prossimità degli equipaggi di navi e sottomarini, a causa della sua minore radioattività. L'isotopo plutonio-238 non è fissile ma può subire facilmente la fissione nucleare con neutroni veloci e decadimento alfa. Tutti gli isotopi di plutonio possono essere "allevati" in materiale fissile con uno o più assorbimenti di neutroni , seguiti o meno da decadimento beta . Ciò rende gli isotopi non fissili del plutonio un materiale fertile .
Isotopi e nucleosintesi
Sono stati caratterizzati venti isotopi radioattivi di plutonio. I più longevi sono il plutonio-244, con un'emivita di 80,8 milioni di anni, il plutonio-242, con un'emivita di 373.300 anni, e il plutonio-239, con un'emivita di 24.110 anni. Tutti i rimanenti isotopi radioattivi hanno emivite inferiori a 7.000 anni. Questo elemento ha anche otto stati metastabili , sebbene tutti abbiano un'emivita inferiore a un secondo. Il plutonio-244 è stato trovato nello spazio interstellare e ha l'emivita più lunga di qualsiasi radioisotopo non primordiale.
Gli isotopi noti del plutonio variano in numero di massa da 228 a 247. Le modalità di decadimento primarie degli isotopi con numeri di massa inferiori all'isotopo più stabile, il plutonio-244, sono la fissione spontanea e l' emissione alfa , formando principalmente uranio (92 protoni ) e nettunio (93 protoni) isotopi come prodotti di decadimento (trascurando l'ampia gamma di nuclei figli creati dai processi di fissione). La modalità di decadimento primaria per gli isotopi con numeri di massa superiori al plutonio-244 è l'emissione beta , che forma principalmente isotopi di americio (95 protoni) come prodotti di decadimento. Il plutonio-241 è l' isotopo genitore della serie di decadimento del nettunio , che decade in americio-241 tramite emissione beta.
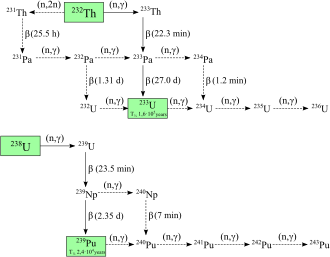
Il plutonio-238 e 239 sono gli isotopi più ampiamente sintetizzati. Il plutonio-239 viene sintetizzato tramite la seguente reazione utilizzando uranio (U) e neutroni (n) tramite decadimento beta (β - ) con nettunio (Np) come intermedio:
I neutroni della fissione dell'uranio-235 vengono catturati dai nuclei di uranio-238 per formare l'uranio-239; un decadimento beta converte un neutrone in un protone per formare nettunio-239 (emivita 2,36 giorni) e un altro decadimento beta forma plutonio-239. Egon Bretscher, che lavorava al progetto British Tube Alloys, predisse teoricamente questa reazione nel 1940.
Il plutonio-238 viene sintetizzato bombardando l'uranio-238 con deuteroni (D, i nuclei dell'idrogeno pesante ) nella seguente reazione:
In questo processo, un deutone che colpisce l'uranio-238 produce due neutroni e il nettunio-238, che decade spontaneamente emettendo particelle beta negative per formare plutonio-238. Il plutonio-238 può anche essere prodotto mediante irradiazione di neutroni del nettunio-237 .
Calore di decadimento e proprietà di fissione
Gli isotopi di plutonio subiscono un decadimento radioattivo, che produce calore di decadimento . Diversi isotopi producono diverse quantità di calore per massa. Il calore di decadimento è solitamente elencato come watt/chilogrammo o milliwatt/grammo. In pezzi più grandi di plutonio (ad esempio una fossa di armi) e una rimozione inadeguata del calore, l'autoriscaldamento risultante può essere significativo.
| Isotopo | Modalità decadimento | Emivita (anni) | Calore di decadimento (W/kg) | Neutroni di fissione spontanea (1/(g·s)) | Commento |
|---|---|---|---|---|---|
| 238 Pu | alfa a 234 U | 87,74 | 560 | 2600 | Calore di decadimento molto elevato. Anche in piccole quantità può causare un notevole autoriscaldamento. Utilizzato da solo nei generatori termoelettrici di radioisotopi . |
| 239 Pu | alfa a 235 U | 24100 | 1.9 | 0,022 | Il principale isotopo fissile in uso. |
| 240 Pu | alfa a 236 U , fissione spontanea | 6560 | 6.8 | 910 | La principale impurità nei campioni dell'isotopo 239 Pu. Il grado di plutonio è solitamente indicato come percentuale di 240 Pu. L'elevata fissione spontanea ostacola l'uso nelle armi nucleari. |
| 241 Pu | beta-meno, a 241 Am | 14.4 | 4.2 | 0,049 | Decadimenti in americio-241; il suo accumulo presenta un rischio di radiazioni nei campioni più vecchi. |
| 242 Pu | alfa a 238 U | 376000 | 0.1 | 1700 | 242 Pu decade a 238 U attraverso il decadimento alfa; decade anche per fissione spontanea. |
Composti e chimica
A temperatura ambiente, il plutonio puro è di colore argenteo ma si appanna quando viene ossidato. L'elemento mostra quattro stati di ossidazione ionica comuni in soluzione acquosa e uno raro:
- Pu(III), come Pu 3+ (lavanda blu)
- Pu(IV), come Pu 4+ (marrone giallo)
- Pu(V), come PuO+
2(rosa chiaro) - Pu(VI), come PuO2+
2(rosa arancione) - Pu(VII), come PuO3-5
_(verde): lo ione eptavalente è raro.
Il colore mostrato dalle soluzioni di plutonio dipende sia dallo stato di ossidazione che dalla natura dell'anione acido . È l'anione acido che influenza il grado di complessazione - il modo in cui gli atomi si connettono a un atomo centrale - delle specie di plutonio. Inoltre, lo stato formale di ossidazione +2 del plutonio è noto nel complesso [K(2.2.2-cryptand)] [Pu II Cp″ 3 ], Cp″ = C 5 H 3 (SiMe 3 ) 2 .
Uno stato di ossidazione +8 è possibile anche nel tetrossido volatile PuO
4. Sebbene si decomponga prontamente tramite un meccanismo di riduzione simile a FeO
4, PuO
4può essere stabilizzato in soluzioni alcaline e cloroformio .
Il plutonio metallico viene prodotto facendo reagire il tetrafluoruro di plutonio con bario , calcio o litio a 1200 °C. Il plutonio metallico viene attaccato dagli acidi , dall'ossigeno e dal vapore ma non dagli alcali e si dissolve facilmente negli acidi cloridrico , idroiodico e perclorico concentrati . Il metallo fuso deve essere mantenuto sotto vuoto o in un'atmosfera inerte per evitare la reazione con l'aria. A 135 °C il metallo si accenderà all'aria ed esploderà se posto in tetracloruro di carbonio .

Il plutonio è un metallo reattivo. In aria umida o argon umido , il metallo si ossida rapidamente, producendo una miscela di ossidi e idruri . Se il metallo viene esposto abbastanza a lungo a una quantità limitata di vapore acqueo, si forma un rivestimento superficiale polveroso di PuO 2 . Si forma anche idruro di plutonio ma un eccesso di vapore acqueo forma solo PuO 2 .
Il plutonio mostra velocità di reazione enormi e reversibili con l'idrogeno puro, formando idruro di plutonio . Inoltre reagisce prontamente con l'ossigeno, formando PuO e PuO 2 nonché ossidi intermedi; l'ossido di plutonio riempie il 40% in più di volume rispetto al plutonio metallico. Il metallo reagisce con gli alogeni dando origine a composti con formula generale PuX 3 dove X può essere F , Cl , Br o I e si vede anche PuF 4 . Si osservano i seguenti ossialogenuri: PuOCl, PuOBr e PuOI. Reagirà con il carbonio per formare PuC, l'azoto per formare PuN e il silicio per formare PuSi 2 .
La chimica organometallica dei complessi di plutonio è tipica delle specie organoattinidi ; un esempio caratteristico di composto di organoplutonio è il plutonocene . I metodi di chimica computazionale indicano un carattere covalente potenziato nel legame plutonio-ligando.
Le polveri di plutonio, i suoi idruri e alcuni ossidi come il Pu 2 O 3 sono piroforici , nel senso che possono accendersi spontaneamente a temperatura ambiente e vengono quindi maneggiati in un'atmosfera inerte e secca di azoto o argon. Il plutonio sfuso si accende solo se riscaldato oltre i 400 °C. Pu 2 O 3 si riscalda spontaneamente e si trasforma in PuO 2 , che è stabile nell'aria secca, ma reagisce con il vapore acqueo quando riscaldato.
I crogioli utilizzati per contenere il plutonio devono essere in grado di resistere alle sue proprietà fortemente riducenti . Metalli refrattari come tantalio e tungsteno insieme agli ossidi, boruri , carburi , nitruri e siliciuri più stabili possono tollerare questo. La fusione in un forno ad arco elettrico può essere utilizzata per produrre piccoli lingotti di metallo senza la necessità di un crogiolo.
Il cerio è utilizzato come simulante chimico del plutonio per lo sviluppo di contenimento, estrazione e altre tecnologie.
Struttura elettronica
Il plutonio è un elemento in cui gli elettroni 5f sono il confine di transizione tra delocalizzato e localizzato; è quindi considerato uno degli elementi più complessi. Il comportamento anomalo del plutonio è causato dalla sua struttura elettronica. La differenza di energia tra le subshell 6d e 5f è molto bassa. La dimensione del guscio 5f è appena sufficiente per consentire agli elettroni di formare legami all'interno del reticolo, proprio al confine tra comportamento localizzato e legame. La vicinanza dei livelli di energia porta a molteplici configurazioni di elettroni a bassa energia con livelli di energia quasi uguali. Ciò porta a configurazioni concorrenti 5f n 7s 2 e 5f n−1 6d 1 7s 2 , che causano la complessità del suo comportamento chimico. La natura altamente direzionale degli orbitali 5f è responsabile dei legami covalenti direzionali nelle molecole e nei complessi di plutonio.
Leghe
Il plutonio può formare leghe e composti intermedi con la maggior parte degli altri metalli. Le eccezioni includono litio, sodio , potassio , rubidio e cesio dei metalli alcalini ; e magnesio , calcio, stronzio e bario dei metalli alcalino terrosi ; ed europio e itterbio dei metalli delle terre rare . Eccezioni parziali includono i metalli refrattari cromo , molibdeno , niobio , tantalio e tungsteno, che sono solubili nel plutonio liquido, ma insolubili o solo leggermente solubili nel plutonio solido. Gallio, alluminio, americio, scandio e cerio possono stabilizzare la fase δ del plutonio a temperatura ambiente. Il silicio , l'indio , lo zinco e lo zirconio consentono la formazione di uno stato δ metastabile quando vengono raffreddati rapidamente. Elevate quantità di afnio , olmio e tallio consentono anche una certa ritenzione della fase δ a temperatura ambiente. Il nettunio è l'unico elemento in grado di stabilizzare la fase α a temperature più elevate.
Le leghe di plutonio possono essere prodotte aggiungendo un metallo al plutonio fuso. Se il metallo legante è sufficientemente riducente, il plutonio può essere aggiunto sotto forma di ossidi o alogenuri. Le leghe plutonio-gallio e plutonio-alluminio in fase δ vengono prodotte aggiungendo fluoruro di plutonio (III) al gallio o all'alluminio fuso, il che ha il vantaggio di evitare di trattare direttamente con il metallo plutonio altamente reattivo.
- Il plutonio-gallio viene utilizzato per stabilizzare la fase δ del plutonio, evitando i problemi correlati alla fase α e α-δ. Il suo utilizzo principale è nelle fosse di implosione di armi nucleari .
- Il plutonio-alluminio è un'alternativa alla lega Pu-Ga. Era l'elemento originale considerato per la stabilizzazione della fase δ, ma la sua tendenza a reagire con le particelle alfa e rilasciare neutroni riduce la sua utilizzabilità per le fosse di armi nucleari. La lega plutonio-alluminio può essere utilizzata anche come componente del combustibile nucleare .
- La lega di plutonio-gallio-cobalto (PuCoGa 5 ) è un superconduttore non convenzionale , che mostra una superconduttività inferiore a 18,5 K, un ordine di grandezza superiore al più alto tra i sistemi di fermioni pesanti e ha una grande corrente critica.
- La lega di plutonio-zirconio può essere utilizzata come combustibile nucleare .
- Le leghe plutonio-cerio e plutonio-cerio-cobalto sono utilizzate come combustibili nucleari.
- Il plutonio-uranio , con circa il 15-30% in moli di plutonio, può essere utilizzato come combustibile nucleare per reattori autofertilizzanti veloci. La sua natura piroforica e l'elevata suscettibilità alla corrosione fino al punto di autoaccensione o disintegrazione dopo l'esposizione all'aria richiedono la lega con altri componenti. L'aggiunta di alluminio, carbonio o rame non migliora notevolmente i tassi di disintegrazione, le leghe di zirconio e ferro hanno una migliore resistenza alla corrosione ma si disintegrano anche in alcuni mesi all'aria. L'aggiunta di titanio e/o zirconio aumenta notevolmente il punto di fusione della lega.
- Plutonio-uranio-titanio e plutonio-uranio-zirconio sono stati studiati per l'uso come combustibili nucleari. L'aggiunta del terzo elemento aumenta la resistenza alla corrosione, riduce l'infiammabilità e migliora la duttilità, la lavorabilità, la resistenza e l'espansione termica. Il plutonio-uranio-molibdeno ha la migliore resistenza alla corrosione, formando un film protettivo di ossidi, ma il titanio e lo zirconio sono preferiti per ragioni fisiche.
- Il torio-uranio-plutonio è stato studiato come combustibile nucleare per reattori autofertilizzanti veloci.
Evento

In natura si possono trovare tracce di plutonio-238, plutonio-239, plutonio-240 e plutonio-244. Piccole tracce di plutonio-239, poche parti per trilione , e dei suoi prodotti di decadimento si trovano naturalmente in alcuni minerali concentrati di uranio, come il reattore a fissione nucleare naturale di Oklo , in Gabon . Il rapporto tra plutonio-239 e uranio nel deposito di uranio della miniera di Cigar Lake varia da2,4 × 10 −12 a44 × 10-12 . _ Queste tracce di 239 Pu hanno origine nel modo seguente: in rare occasioni, 238 U subisce una fissione spontanea e, nel processo, il nucleo emette uno o due neutroni liberi con una certa energia cinetica. Quando uno di questi neutroni colpisce il nucleo di un altro atomo di 238 U, viene assorbito dall'atomo, che diventa 239 U. Con un'emivita relativamente breve, 239 U decade in 239 Np, che decade in 239 Pu. Infine, quantità estremamente piccole di plutonio-238, attribuite al rarissimo doppio decadimento beta dell'uranio-238, sono state trovate in campioni di uranio naturale.
A causa della sua emivita relativamente lunga di circa 80 milioni di anni, è stato suggerito che il plutonio-244 si presenti naturalmente come nuclide primordiale , ma non è stato possibile confermare i primi rapporti sulla sua individuazione. Tuttavia, la sua lunga emivita ha assicurato la sua circolazione attraverso il sistema solare prima della sua estinzione e, in effetti, nei meteoriti sono state trovate prove della fissione spontanea del 244 Pu estinto. La precedente presenza di 244 Pu nel Sistema Solare primordiale è stata confermata, poiché si manifesta oggi come un eccesso delle sue figlie, o 232 Th (dal percorso di decadimento alfa) o isotopi di xeno (dalla sua fissione spontanea ). Questi ultimi sono generalmente più utili, perché le sostanze chimiche del torio e del plutonio sono piuttosto simili (entrambi sono prevalentemente tetravalenti) e quindi un eccesso di torio non sarebbe una prova evidente che una parte di esso si sia formata come figlia del plutonio. 244 Pu ha l'emivita più lunga di tutti i nuclidi transuranici ed è prodotto solo nel processo r nelle supernove e nelle stelle di neutroni in collisione ; quando i nuclei vengono espulsi da questi eventi ad alta velocità per raggiungere la Terra, solo il 244 Pu tra i nuclidi transuranici ha un'emivita abbastanza lunga per sopravvivere al viaggio, e quindi minuscole tracce di 244 Pu interstellare vivo sono state trovate nelle profondità del fondo marino. Poiché 240 Pu si trova anche nella catena di decadimento di 244 Pu, deve quindi essere presente anche in equilibrio secolare , anche se in quantità ancora più piccole.
Tracce minuscole di plutonio si trovano solitamente nel corpo umano a causa dei 550 test nucleari atmosferici e subacquei che sono stati effettuati e di un piccolo numero di gravi incidenti nucleari . La maggior parte dei test nucleari atmosferici e sottomarini è stata interrotta dal Trattato sul divieto di test limitati nel 1963, che delle potenze nucleari è stato firmato e ratificato da Stati Uniti, Regno Unito e Unione Sovietica . La Francia avrebbe continuato i test nucleari atmosferici fino al 1974 e la Cina avrebbe continuato i test nucleari atmosferici fino al 1980. Tutti i successivi test nucleari furono condotti sottoterra.
Storia
Scoperta
Enrico Fermi e un gruppo di scienziati dell'Università di Roma riferirono di aver scoperto l'elemento 94 nel 1934. Fermi chiamò l'elemento esperio e lo menzionò nella sua conferenza per il Nobel nel 1938. Il campione conteneva in realtà prodotti della fissione nucleare , principalmente bario e krypton . . La fissione nucleare, scoperta in Germania nel 1938 da Otto Hahn e Fritz Strassmann , all'epoca era sconosciuta.

Il plutonio (in particolare il plutonio-238) fu prodotto, isolato e poi identificato chimicamente tra il dicembre 1940 e il febbraio 1941 da Glenn T. Seaborg , Edwin McMillan , Emilio Segrè , Joseph W. Kennedy e Arthur Wahl mediante bombardamento di deuteroni dell'uranio nel Ciclotrone da 60 pollici (150 cm) presso il Berkeley Radiation Laboratory dell'Università della California, Berkeley . Il nettunio-238 è stato creato direttamente dal bombardamento ma è decaduto per emissione beta con un'emivita di poco più di due giorni, che indicava la formazione dell'elemento 94. Il primo bombardamento ebbe luogo il 14 dicembre 1940 e il nuovo elemento fu identificato per la prima volta attraverso l'ossidazione nella notte tra il 23 e il 24 febbraio 1941.
Un documento che documenta la scoperta è stato preparato dal team e inviato alla rivista Physical Review nel marzo 1941, ma la pubblicazione è stata ritardata fino a un anno dopo la fine della seconda guerra mondiale a causa di problemi di sicurezza. Al Cavendish Laboratory di Cambridge , Egon Bretscher e Norman Feather si resero conto che un reattore a neutroni lenti alimentato con uranio avrebbe teoricamente prodotto notevoli quantità di plutonio-239 come sottoprodotto. Hanno calcolato che l'elemento 94 sarebbe fissile e avrebbe avuto l'ulteriore vantaggio di essere chimicamente diverso dall'uranio e potrebbe essere facilmente separato da esso.
McMillan aveva recentemente chiamato il primo elemento transuranico nettunio dopo il pianeta Nettuno e suggerì che l'elemento 94, essendo l'elemento successivo della serie, prendesse il nome da quello che allora era considerato il pianeta successivo, Plutone . Nicholas Kemmer del team di Cambridge ha proposto in modo indipendente lo stesso nome, basato sullo stesso ragionamento del team di Berkeley. Seaborg originariamente considerava il nome "plutium", ma in seguito pensò che non suonasse bene come "plutonium". Scelse per scherzo le lettere "Pu", in riferimento all'interiezione "P U" per indicare un odore particolarmente disgustoso, che passò senza preavviso nella tavola periodica. I nomi alternativi considerati da Seaborg e altri erano "ultimium" o "extremium" a causa dell'errata convinzione di aver trovato l'ultimo elemento possibile sulla tavola periodica .
Hahn e Strassmann, e indipendentemente Kurt Starke , stavano a questo punto lavorando anche su elementi transuranici a Berlino. È probabile che Hahn e Strassmann sapessero che il plutonio-239 doveva essere fissile. Tuttavia, non avevano una forte sorgente di neutroni. L'elemento 93 fu segnalato da Hahn e Strassmann, così come da Starke, nel 1942. Il gruppo di Hahn non inseguì l'elemento 94, probabilmente perché scoraggiato dall'insuccesso di McMillan e Abelson nell'isolarlo quando avevano trovato per la prima volta l'elemento 93. Tuttavia, poiché a questo punto il gruppo di Hahn aveva accesso al ciclotrone più potente di Parigi, probabilmente sarebbero stati in grado di rilevare il plutonio se avessero provato, anche se in quantità minuscole (pochi becquerel ).
Prime ricerche
La chimica del plutonio è risultata simile all'uranio dopo alcuni mesi di studi iniziali. Le prime ricerche furono proseguite presso il segreto Metallurgical Laboratory dell'Università di Chicago . Il 20 agosto 1942 una traccia di questo elemento fu isolata e misurata per la prima volta. Sono stati prodotti circa 50 microgrammi di plutonio-239 combinato con uranio e prodotti di fissione e solo circa 1 microgrammo è stato isolato. Questa procedura ha permesso ai chimici di determinare il peso atomico del nuovo elemento. Il 2 dicembre 1942, in un campo da racket sotto la tribuna ovest dello Stagg Field dell'Università di Chicago, i ricercatori guidati da Enrico Fermi realizzarono la prima reazione a catena autosufficiente in una pila di grafite e uranio nota come CP-1 . Utilizzando le informazioni teoriche raccolte dal funzionamento di CP-1, DuPont ha costruito un reattore di produzione sperimentale raffreddato ad aria, noto come X-10 , e un impianto di separazione chimica pilota a Oak Ridge. L'impianto di separazione, utilizzando metodi sviluppati da Glenn T. Seaborg e un team di ricercatori del Met Lab, ha rimosso il plutonio dall'uranio irradiato nel reattore X-10. Le informazioni del CP-1 sono state utili anche agli scienziati del Met Lab che progettavano i reattori per la produzione di plutonio raffreddati ad acqua per Hanford. La costruzione del sito iniziò a metà del 1943.
Nel novembre 1943 fu ridotto del trifluoruro di plutonio per creare il primo campione di plutonio metallico: pochi microgrammi di perline metalliche. È stato prodotto abbastanza plutonio da renderlo il primo elemento sinteticamente visibile ad occhio nudo.
Sono state studiate anche le proprietà nucleari del plutonio-239; i ricercatori hanno scoperto che quando viene colpito da un neutrone si rompe (fissioni) rilasciando più neutroni ed energia. Questi neutroni possono colpire altri atomi di plutonio-239 e così via in una reazione a catena esponenzialmente veloce. Ciò può provocare un'esplosione abbastanza grande da distruggere una città se una quantità sufficiente di isotopo è concentrata per formare una massa critica .
Durante le prime fasi della ricerca, gli animali venivano usati per studiare gli effetti delle sostanze radioattive sulla salute. Questi studi iniziarono nel 1944 presso l'Università della California al Radiation Laboratory di Berkeley e furono condotti da Joseph G. Hamilton. Hamilton stava cercando di rispondere a domande su come il plutonio varierebbe nel corpo a seconda della modalità di esposizione (ingestione orale, inalazione, assorbimento attraverso la pelle), dei tassi di ritenzione e di come il plutonio sarebbe stato fissato nei tessuti e distribuito tra i vari organi. Hamilton iniziò a somministrare ai ratti porzioni di microgrammi solubili di composti di plutonio-239 utilizzando diversi stati di valenza e diversi metodi di introduzione del plutonio (orale, endovenoso, ecc.). Alla fine, il laboratorio di Chicago ha anche condotto i propri esperimenti di iniezione di plutonio utilizzando diversi animali come topi, conigli, pesci e persino cani. I risultati degli studi di Berkeley e Chicago hanno mostrato che il comportamento fisiologico del plutonio differiva significativamente da quello del radio. Il risultato più allarmante è stato che vi è stata una significativa deposizione di plutonio nel fegato e nella porzione di osso "attivamente metabolizzante". Inoltre, il tasso di eliminazione del plutonio negli escrementi differiva tra le specie di animali fino a un fattore cinque. Tale variazione ha reso estremamente difficile stimare quale sarebbe il tasso per gli esseri umani.
Produzione durante il Progetto Manhattan
Durante la seconda guerra mondiale il governo degli Stati Uniti istituì il Progetto Manhattan , che aveva il compito di sviluppare una bomba atomica. I tre principali siti di ricerca e produzione del progetto erano l'impianto di produzione di plutonio in quello che oggi è il sito di Hanford , gli impianti di arricchimento dell'uranio a Oak Ridge, nel Tennessee , e il laboratorio di ricerca e progettazione di armi, ora noto come Los Alamos National Laboratory .


Il primo reattore di produzione che ha prodotto il plutonio-239 è stato il reattore di grafite X-10 . Andò online nel 1943 e fu costruito in una struttura a Oak Ridge che in seguito divenne l' Oak Ridge National Laboratory .
Nel gennaio 1944, i lavoratori gettarono le basi per il primo edificio di separazione chimica, T Plant situato a 200-West. Sia lo stabilimento T che il suo impianto gemello a 200-West, lo stabilimento U, sono stati completati entro ottobre. (U Plant è stato utilizzato solo per l'addestramento durante il Progetto Manhattan.) L'edificio di separazione in 200-East, B Plant, è stato completato nel febbraio 1945. La seconda struttura pianificata per 200-East è stata cancellata. Soprannominati Queen Marys dagli operai che li costruirono, gli edifici di separazione erano fantastiche strutture simili a canyon lunghe 800 piedi, larghe 65 piedi e alte 80 piedi contenenti quaranta vasche di processo. L'interno aveva una qualità inquietante poiché gli operatori dietro sette piedi di schermatura di cemento manipolavano apparecchiature di controllo remoto guardando attraverso monitor televisivi e periscopi da una galleria superiore. Anche con massicci coperchi in cemento sulle vasche di processo, le precauzioni contro l'esposizione alle radiazioni erano necessarie e hanno influenzato tutti gli aspetti della progettazione dell'impianto.
Il 5 aprile 1944 Emilio Segrè a Los Alamos ricevette il primo campione di plutonio prodotto dal reattore da Oak Ridge. Nel giro di dieci giorni scoprì che il plutonio prodotto dal reattore aveva una maggiore concentrazione dell'isotopo plutonio-240 rispetto al plutonio prodotto dal ciclotrone. Il plutonio-240 ha un alto tasso di fissione spontanea, aumentando il livello generale di neutroni di fondo del campione di plutonio. Di conseguenza , l'originale arma al plutonio del tipo a pistola , nome in codice " Thin Man ", dovette essere abbandonata: l'aumento del numero di neutroni spontanei significava che era probabile la pre-detonazione nucleare ( fizzle ).
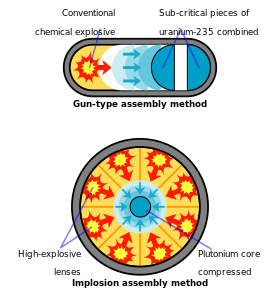
L'intero sforzo di progettazione di armi al plutonio a Los Alamos fu presto cambiato nel più complicato dispositivo di implosione, nome in codice " Fat Man ". Con un'arma a implosione, il plutonio viene compresso a un'alta densità con lenti esplosive , un compito tecnicamente più arduo rispetto al semplice design del tipo di pistola, ma necessario per utilizzare il plutonio a scopo di armamento. L'uranio arricchito , al contrario, può essere utilizzato con entrambi i metodi.
La costruzione del reattore Hanford B , il primo reattore nucleare di dimensioni industriali ai fini della produzione di materiale, fu completata nel marzo 1945. Il reattore B produsse il materiale fissile per le armi al plutonio utilizzate durante la seconda guerra mondiale. B, D e F furono i primi reattori costruiti a Hanford, e successivamente sul sito furono costruiti altri sei reattori per la produzione di plutonio.
Entro la fine di gennaio 1945, il plutonio altamente purificato subì un'ulteriore concentrazione nell'edificio di isolamento chimico completato, dove le impurità rimanenti furono rimosse con successo. Los Alamos ha ricevuto il suo primo plutonio da Hanford il 2 febbraio. Sebbene non fosse ancora affatto chiaro che si potesse produrre abbastanza plutonio da utilizzare nelle bombe entro la fine della guerra, Hanford era operativa all'inizio del 1945. Erano passati solo due anni da quando il colonnello Franklin Matthias aveva stabilito per la prima volta il suo quartier generale temporaneo sulle rive del fiume Columbia.
Secondo Kate Brown , gli impianti di produzione di plutonio di Hanford e Mayak in Russia, per un periodo di quattro decenni, "hanno entrambi rilasciato più di 200 milioni di curie di isotopi radioattivi nell'ambiente circostante, il doppio della quantità espulsa nel disastro di Chernobyl in ciascun caso. ". La maggior parte di questa contaminazione radioattiva nel corso degli anni faceva parte delle normali operazioni, ma si sono verificati incidenti imprevisti e la gestione dell'impianto ha mantenuto questo segreto, poiché l'inquinamento è continuato senza sosta.
Nel 2004, durante gli scavi di una fossa funeraria nel sito nucleare di Hanford, è stata scoperta una cassaforte . All'interno della cassaforte c'erano vari oggetti, tra cui una grande bottiglia di vetro contenente un impasto biancastro che è stato successivamente identificato come il più antico campione di plutonio per uso militare conosciuto. L'analisi degli isotopi del Pacific Northwest National Laboratory ha indicato che il plutonio nella bottiglia è stato prodotto nel reattore di grafite X-10 a Oak Ridge nel 1944.
Bombe atomiche Trinity e Fat Man
Il primo test della bomba atomica, nome in codice "Trinity" e fatto esplodere il 16 luglio 1945, vicino ad Alamogordo, nel New Mexico , utilizzava il plutonio come materiale fissile. Il progetto di implosione del " gadget ", come era chiamato in codice il dispositivo Trinity, utilizzava lenti esplosive convenzionali per comprimere una sfera di plutonio in una massa supercritica, che veniva simultaneamente inondata di neutroni dall'"Urchin", un iniziatore fatto di polonio e berillio ( sorgente di neutroni : (α, n) reazione ). Insieme, questi hanno assicurato una reazione a catena e un'esplosione fuori controllo. L'arma complessiva pesava oltre 4 tonnellate , sebbene utilizzasse solo 6,2 kg di plutonio nel suo nucleo. Circa il 20% del plutonio utilizzato nell'arma Trinity subì la fissione, provocando un'esplosione con un'energia equivalente a circa 20.000 tonnellate di TNT.
Un design identico è stato utilizzato nella bomba atomica "Fat Man" sganciata su Nagasaki , in Giappone , il 9 agosto 1945, uccidendo 35.000-40.000 persone e distruggendo il 68% -80% della produzione bellica a Nagasaki. Solo dopo l'annuncio delle prime bombe atomiche l'esistenza e il nome del plutonio furono resi noti al pubblico dallo Smyth Report del Progetto Manhattan .
Usi e sprechi della Guerra Fredda
Grandi scorte di plutonio per armi furono accumulate sia dall'Unione Sovietica che dagli Stati Uniti durante la Guerra Fredda . I reattori statunitensi di Hanford e del sito del fiume Savannah nella Carolina del Sud hanno prodotto 103 tonnellate e nell'URSS sono state prodotte circa 170 tonnellate di plutonio di tipo militare. Ogni anno circa 20 tonnellate dell'elemento vengono ancora prodotte come sottoprodotto dell'industria dell'energia nucleare . Fino a 1000 tonnellate di plutonio possono essere immagazzinate con più di 200 tonnellate all'interno o estratte da armi nucleari. Il SIPRI ha stimato le scorte mondiali di plutonio nel 2007 in circa 500 tonnellate, divise equamente tra armi e scorte civili.
La contaminazione radioattiva presso l' impianto di Rocky Flats è stata principalmente il risultato di due grandi incendi di plutonio nel 1957 e nel 1969. Concentrazioni molto inferiori di isotopi radioattivi sono state rilasciate durante la vita operativa dell'impianto dal 1952 al 1992. I venti prevalenti dall'impianto hanno trasportato la contaminazione aerea a sud e ad est , in aree popolate a nord-ovest di Denver. La contaminazione dell'area di Denver da parte del plutonio degli incendi e di altre fonti non è stata segnalata pubblicamente fino agli anni '70. Secondo uno studio del 1972 coautore di Edward Martell , "Nelle aree più densamente popolate di Denver, il livello di contaminazione da Pu nei suoli superficiali è più volte ricaduta", e la contaminazione da plutonio "appena ad est dell'impianto di Rocky Flats varia fino a centinaia di volte che dai test nucleari". Come notato da Carl Johnson in Ambio , "Le esposizioni di una vasta popolazione nell'area di Denver al plutonio e ad altri radionuclidi nei pennacchi di scarico dell'impianto risalgono al 1953". La produzione di armi nello stabilimento di Rocky Flats è stata interrotta dopo un raid combinato dell'FBI e dell'EPA nel 1989 e anni di proteste. Da allora l'impianto è stato chiuso, con i suoi edifici demoliti e completamente rimossi dal sito.
Negli Stati Uniti, parte del plutonio estratto da armi nucleari smantellate viene fuso per formare ceppi di vetro di ossido di plutonio che pesano due tonnellate. Il vetro è composto da borosilicati mescolati con cadmio e gadolinio . Questi tronchi dovrebbero essere racchiusi in acciaio inossidabile e immagazzinati fino a 4 km (2 miglia) sottoterra in fori che saranno riempiti di cemento . Gli Stati Uniti hanno pianificato di immagazzinare il plutonio in questo modo presso il deposito di scorie nucleari di Yucca Mountain , che si trova a circa 100 miglia (160 km) a nord-est di Las Vegas, Nevada .
Il 5 marzo 2009, il segretario all'Energia Steven Chu ha dichiarato in un'udienza al Senato che "il sito di Yucca Mountain non era più visto come un'opzione per lo stoccaggio dei rifiuti del reattore". A partire dal 1999, le scorie nucleari di origine militare vengono sepolte presso l' impianto pilota di isolamento dei rifiuti nel New Mexico.
In un memorandum presidenziale datato 29 gennaio 2010, il presidente Obama ha istituito la Blue Ribbon Commission on America's Nuclear Future . Nella loro relazione finale la Commissione ha formulato raccomandazioni per lo sviluppo di una strategia globale da perseguire, tra cui:
- "Raccomandazione n. 1: gli Stati Uniti dovrebbero intraprendere un programma integrato di gestione dei rifiuti nucleari che porti allo sviluppo tempestivo di una o più strutture geologiche profonde permanenti per lo smaltimento sicuro del combustibile esaurito e dei rifiuti nucleari ad alto livello".
Sperimentazione medica
Durante e dopo la fine della seconda guerra mondiale, gli scienziati che lavoravano al Progetto Manhattan e ad altri progetti di ricerca sulle armi nucleari hanno condotto studi sugli effetti del plutonio su animali da laboratorio e soggetti umani. Studi sugli animali hanno scoperto che pochi milligrammi di plutonio per chilogrammo di tessuto sono una dose letale.
Nel caso di soggetti umani, ciò comportava l'iniezione di soluzioni contenenti (tipicamente) cinque microgrammi di plutonio in pazienti ospedalieri ritenuti malati terminali o con un'aspettativa di vita inferiore a dieci anni a causa dell'età o della condizione di malattia cronica. Questo fu ridotto a un microgrammo nel luglio 1945 dopo che studi sugli animali scoprirono che il modo in cui il plutonio si distribuiva nelle ossa era più pericoloso del radio . La maggior parte dei soggetti, dice Eileen Welsome , erano poveri, impotenti e malati.
Dal 1945 al 1947, a diciotto soggetti umani fu iniettato plutonio senza consenso informato . I test sono stati utilizzati per creare strumenti diagnostici per determinare l'assorbimento di plutonio nel corpo al fine di sviluppare standard di sicurezza per lavorare con il plutonio. Ebb Cade partecipò riluttante a esperimenti medici che prevedevano l'iniezione di 4,7 microgrammi di plutonio il 10 aprile 1945 a Oak Ridge, nel Tennessee . Questo esperimento era sotto la supervisione di Harold Hodge . Altri esperimenti diretti dalla Commissione per l'energia atomica degli Stati Uniti e dal Progetto Manhattan continuarono negli anni '70. The Plutonium Files racconta le vite dei soggetti del programma segreto nominando ogni persona coinvolta e discutendo la ricerca etica e medica condotta in segreto da scienziati e medici. L'episodio è ora considerato una grave violazione dell'etica medica e del giuramento di Ippocrate .
Il governo ha coperto la maggior parte di questi contrattempi dovuti alle radiazioni fino al 1993, quando il presidente Bill Clinton ha ordinato un cambio di politica e le agenzie federali hanno quindi reso disponibili i documenti pertinenti. L'indagine risultante è stata intrapresa dal comitato consultivo del presidente sugli esperimenti sulle radiazioni umane e ha scoperto gran parte del materiale sulla ricerca sul plutonio sugli esseri umani. Il comitato ha pubblicato un controverso rapporto del 1995 in cui si afferma che "sono stati commessi torti" ma non ha condannato coloro che li hanno perpetrati.
Applicazioni
Esplosivi

L'isotopo plutonio-239 è un componente fissile chiave nelle armi nucleari, grazie alla sua facilità di fissione e disponibilità. Racchiudere la fossa di plutonio della bomba in un tamper (uno strato facoltativo di materiale denso) riduce la quantità di plutonio necessaria per raggiungere la massa critica riflettendo i neutroni in fuga nel nucleo di plutonio. Ciò riduce la quantità di plutonio necessaria per raggiungere la criticità da 16 kg a 10 kg, che è una sfera con un diametro di circa 10 centimetri (4 pollici). Questa massa critica è circa un terzo di quella dell'uranio-235.
Le bombe al plutonio Fat Man utilizzavano la compressione esplosiva del plutonio per ottenere densità significativamente più elevate del normale, combinate con una sorgente centrale di neutroni per iniziare la reazione e aumentare l'efficienza. Così sono stati necessari solo 6,2 kg di plutonio per una resa esplosiva equivalente a 20 chilotoni di TNT. Ipoteticamente, solo 4 kg di plutonio, e forse anche meno, potrebbero essere utilizzati per realizzare una singola bomba atomica utilizzando progetti di assemblaggio molto sofisticati.
Combustibile a ossidi misti
Il combustibile nucleare esaurito dei normali reattori ad acqua leggera contiene plutonio, ma è una miscela di plutonio-242 , 240, 239 e 238. La miscela non è sufficientemente arricchita per armi nucleari efficienti, ma può essere utilizzata una volta come combustibile MOX . La cattura accidentale di neutroni fa aumentare la quantità di plutonio-242 e 240 ogni volta che il plutonio viene irradiato in un reattore con neutroni "termici" a bassa velocità, in modo che dopo il secondo ciclo, il plutonio possa essere consumato solo da reattori a neutroni veloci . Se i reattori a neutroni veloci non sono disponibili (il caso normale), il plutonio in eccesso viene solitamente scartato e forma uno dei componenti più longevi delle scorie nucleari. Il desiderio di consumare questo plutonio e altri combustibili transuranici e ridurre la radiotossicità delle scorie è la solita ragione addotta dagli ingegneri nucleari per realizzare reattori a neutroni veloci.
Il processo chimico più comune, PUREX ( P lutonium– UR anium EX traction), rielabora il combustibile nucleare esaurito per estrarre plutonio e uranio che possono essere utilizzati per formare un combustibile a ossido misto (MOX) da riutilizzare nei reattori nucleari. Il plutonio per armi può essere aggiunto alla miscela di carburante. Il combustibile MOX viene utilizzato nei reattori ad acqua leggera ed è costituito da 60 kg di plutonio per tonnellata di combustibile; dopo quattro anni tre quarti del plutonio vengono bruciati (trasformati in altri elementi). I reattori autofertilizzanti sono specificamente progettati per creare più materiale fissile di quanto ne consumino.
Il carburante MOX è in uso dagli anni '80 ed è ampiamente utilizzato in Europa. Nel settembre 2000, gli Stati Uniti e la Federazione Russa hanno firmato un accordo per la gestione e lo smaltimento del plutonio in base al quale ciascuno ha concordato di smaltire 34 tonnellate di plutonio per uso militare. Il Dipartimento dell'Energia degli Stati Uniti prevede di smaltire 34 tonnellate di plutonio per uso militare negli Stati Uniti entro la fine del 2019 convertendo il plutonio in un combustibile MOX da utilizzare nei reattori nucleari commerciali.
Il carburante MOX migliora il consumo totale. Una barra di combustibile viene ritrattata dopo tre anni di utilizzo per rimuovere i prodotti di scarto, che a quel punto rappresentano il 3% del peso totale delle barre. Eventuali isotopi di uranio o plutonio prodotti durante quei tre anni vengono lasciati e la barra torna in produzione. La presenza fino all'1% di gallio per massa nella lega di plutonio per armi ha il potenziale di interferire con il funzionamento a lungo termine di un reattore ad acqua leggera.
Il plutonio recuperato dal combustibile esaurito del reattore pone pochi rischi di proliferazione, a causa dell'eccessiva contaminazione con plutonio-240 e plutonio-242 non fissile. La separazione degli isotopi non è fattibile. Un reattore dedicato che opera con un consumo molto basso (quindi un'esposizione minima del plutonio-239 di nuova formazione a neutroni aggiuntivi che ne provoca la trasformazione in isotopi più pesanti di plutonio) è generalmente richiesto per produrre materiale adatto all'uso in armi nucleari efficienti . Mentre il plutonio "per armi" è definito per contenere almeno il 92% di plutonio-239 (del plutonio totale), gli Stati Uniti sono riusciti a far esplodere un ordigno sotto i 20 Kt utilizzando plutonio che si ritiene contenga solo circa l'85% di plutonio-239, cosiddetto plutonio "combustibile". Il plutonio "di grado reattore" prodotto da un normale ciclo di combustione LWR contiene tipicamente meno del 60% di Pu-239, con un massimo del 30% di Pu-240 / Pu-242 parassita e il 10-15% di Pu-241 fissile. Non è noto se un dispositivo che utilizza plutonio ottenuto da scorie nucleari civili ritrattate possa essere fatto esplodere, tuttavia un tale dispositivo potrebbe ipoteticamente esaurirsi e diffondere materiali radioattivi su una vasta area urbana. L' AIEA classifica prudentemente il plutonio di tutti i vettori isotopici come materiale "ad uso diretto", cioè "materiale nucleare che può essere utilizzato per la fabbricazione di componenti di esplosivi nucleari senza trasmutazione o ulteriore arricchimento".
Potenza e fonte di calore
L'isotopo plutonio-238 ha un tempo di dimezzamento di 87,74 anni. Emette una grande quantità di energia termica con bassi livelli sia di raggi gamma / fotoni che di raggi/particelle di neutroni spontanei. Essendo un emettitore alfa, combina radiazioni ad alta energia con bassa penetrazione e quindi richiede una schermatura minima. Un foglio di carta può essere utilizzato per proteggersi dalle particelle alfa emesse dal plutonio-238. Un chilogrammo dell'isotopo può generare circa 570 watt di calore.
Queste caratteristiche lo rendono adatto alla generazione di energia elettrica per dispositivi che devono funzionare senza manutenzione diretta per tempi che si avvicinano a una vita umana. Viene quindi utilizzato nei generatori termoelettrici di radioisotopi e nelle unità di riscaldamento dei radioisotopi come quelli delle sonde spaziali Cassini , Voyager , Galileo e New Horizons e dei rover su Marte Curiosity and Perseverance ( Mars 2020 ) .
I due veicoli spaziali Voyager furono lanciati nel 1977, ciascuno contenente una fonte di alimentazione al plutonio da 500 watt. Oltre 30 anni dopo, ciascuna sorgente produce ancora circa 300 watt, il che consente un funzionamento limitato di ciascun veicolo spaziale. Una versione precedente della stessa tecnologia alimentava cinque Apollo Lunar Surface Experiment Packages , a partire dall'Apollo 12 nel 1969.
Il plutonio-238 è stato utilizzato con successo anche per alimentare pacemaker cardiaci artificiali , per ridurre il rischio di interventi chirurgici ripetuti. È stato in gran parte sostituito da celle primarie a base di litio , ma nel 2003 c'erano tra i 50 ei 100 pacemaker alimentati al plutonio ancora impiantati e funzionanti in pazienti viventi negli Stati Uniti. Alla fine del 2007, il numero di pacemaker alimentati al plutonio era sceso a soli nove. Il plutonio-238 è stato studiato come un modo per fornire calore supplementare alle immersioni subacquee . Il plutonio-238 mescolato con il berillio viene utilizzato per generare neutroni a scopo di ricerca.
Precauzioni
Tossicità
Ci sono due aspetti degli effetti dannosi del plutonio: la radioattività e gli effetti velenosi dei metalli pesanti . Gli isotopi ei composti del plutonio sono radioattivi e si accumulano nel midollo osseo . La contaminazione da ossido di plutonio è il risultato di disastri nucleari e incidenti radioattivi , inclusi incidenti nucleari militari in cui sono bruciate armi nucleari. Gli studi sugli effetti di questi rilasci minori, così come sulla diffusa malattia e morte per avvelenamento da radiazioni in seguito ai bombardamenti atomici di Hiroshima e Nagasaki , hanno fornito informazioni considerevoli sui pericoli, i sintomi e la prognosi dell'avvelenamento da radiazioni , che nel caso del I sopravvissuti giapponesi erano in gran parte estranei all'esposizione diretta al plutonio.
Durante il decadimento del plutonio vengono rilasciati tre tipi di radiazioni ionizzanti , vale a dire alfa, beta e gamma. L'esposizione acuta oa lungo termine comporta un pericolo di gravi conseguenze per la salute tra cui malattia da radiazioni , danni genetici , cancro e morte. Il pericolo aumenta con la quantità di esposizione. La radiazione alfa può viaggiare solo per una breve distanza e non può attraversare lo strato esterno e morto della pelle umana. Le radiazioni beta possono penetrare nella pelle umana, ma non possono attraversare tutto il corpo. Le radiazioni gamma possono attraversare tutto il corpo. Anche se le radiazioni alfa non possono penetrare nella pelle, il plutonio ingerito o inalato irradia gli organi interni. È stato scoperto che le particelle alfa generate dal plutonio inalato causano il cancro ai polmoni in una coorte di lavoratori nucleari europei. Lo scheletro , dove si accumula il plutonio, e il fegato , dove si raccoglie e si concentra, sono a rischio. Il plutonio non viene assorbito nel corpo in modo efficiente quando ingerito; solo lo 0,04% dell'ossido di plutonio viene assorbito dopo l'ingestione. Il plutonio assorbito dal corpo viene espulso molto lentamente, con un tempo di dimezzamento biologico di 200 anni. Il plutonio passa solo lentamente attraverso le membrane cellulari e i confini intestinali, quindi l'assorbimento per ingestione e l'incorporazione nella struttura ossea procede molto lentamente. Donald Mastick ha ingerito accidentalmente una piccola quantità di cloruro di plutonio (III) , che è stato rilevabile per i successivi trent'anni della sua vita, ma sembrava non subire effetti negativi.
Il plutonio è più pericoloso se inalato che se ingerito. Il rischio di cancro al polmone aumenta quando la dose totale di radiazione equivalente del plutonio inalato supera i 400 mSv . Il Dipartimento dell'Energia degli Stati Uniti stima che il rischio di cancro nel corso della vita derivante dall'inalazione di 5.000 particelle di plutonio, ciascuna larga circa 3 µm , sia dell'1% superiore alla media statunitense di base. L'ingestione o l'inalazione di grandi quantità può causare avvelenamento acuto da radiazioni e possibilmente la morte. Tuttavia, non si sa che nessun essere umano sia morto a causa dell'inalazione o dell'ingestione di plutonio e molte persone hanno quantità misurabili di plutonio nei loro corpi.
La teoria della " particella calda " in cui una particella di polvere di plutonio irradia un punto localizzato di tessuto polmonare non è supportata dalla ricerca tradizionale: tali particelle sono più mobili di quanto si pensasse originariamente e la tossicità non è aumentata in modo misurabile a causa della forma del particolato. Quando viene inalato, il plutonio può passare nel flusso sanguigno. Una volta nel flusso sanguigno, il plutonio si sposta in tutto il corpo e nelle ossa, nel fegato o in altri organi del corpo. Il plutonio che raggiunge gli organi del corpo generalmente rimane nel corpo per decenni e continua a esporre il tessuto circostante alle radiazioni e quindi può causare il cancro.
Una citazione comunemente citata da Ralph Nader afferma che una libbra di polvere di plutonio diffusa nell'atmosfera sarebbe sufficiente per uccidere 8 miliardi di persone. Ciò è stato contestato da Bernard Cohen , un oppositore del modello lineare senza soglia generalmente accettato di tossicità da radiazioni. Cohen ha stimato che una libbra di plutonio potrebbe uccidere non più di 2 milioni di persone per inalazione, quindi la tossicità del plutonio è approssimativamente equivalente a quella del gas nervino .
Diverse popolazioni di persone che sono state esposte alla polvere di plutonio (ad esempio persone che vivevano sottovento ai siti di test del Nevada, sopravvissuti di Nagasaki, lavoratori degli impianti nucleari e pazienti "malati terminali" a cui è stato iniettato Pu nel 1945-46 per studiare il metabolismo del Pu) sono stati esposti alla polvere di plutonio. attentamente seguito e analizzato. Cohen ha trovato questi studi incoerenti con le stime elevate della tossicità del plutonio, citando casi come Albert Stevens che è sopravvissuto fino alla vecchiaia dopo essere stato iniettato con plutonio. "C'erano circa 25 lavoratori del Los Alamos National Laboratory che hanno inalato una notevole quantità di polvere di plutonio durante gli anni '40; secondo la teoria delle particelle calde, ognuno di loro ha una probabilità del 99,5% di essere morto di cancro ai polmoni ormai, ma ci sono non c'era un solo cancro ai polmoni tra loro".
Tossicità marina
Indagare sulla tossicità del plutonio negli esseri umani è tanto importante quanto osservare gli effetti sulla fauna dei sistemi marini. È noto che il plutonio entra nell'ambiente marino mediante lo scarico di scorie o perdite accidentali da centrali nucleari. Sebbene le più alte concentrazioni di plutonio negli ambienti marini si trovino nei sedimenti, il complesso ciclo biogeochimico del plutonio fa sì che si trovi anche in tutti gli altri comparti. Ad esempio, varie specie di zooplancton che aiutano nel ciclo dei nutrienti consumeranno l'elemento su base giornaliera. La completa escrezione del plutonio ingerito da parte dello zooplancton rende la loro defecazione un meccanismo estremamente importante nell'eliminazione del plutonio dalle acque superficiali. Tuttavia, lo zooplancton che soccombe alla predazione di organismi più grandi può diventare un veicolo di trasmissione del plutonio ai pesci.
Oltre al consumo, i pesci possono essere esposti al plutonio anche per la loro distribuzione geografica in tutto il mondo. Uno studio ha studiato gli effetti degli elementi transuranici ( plutonio-238 , plutonio-239 , plutonio-240 ) su vari pesci che vivono nella zona di esclusione di Chernobyl (CEZ). I risultati hanno mostrato che una percentuale di pesce persico femmina nella CEZ mostrava un fallimento o un ritardo nella maturazione delle gonadi. Studi simili hanno trovato grandi accumuli di plutonio negli organi respiratori e digestivi di merluzzi, passere e aringhe.
La tossicità del plutonio è altrettanto dannosa per le larve dei pesci nelle aree di scorie nucleari. Le uova non sviluppate hanno un rischio maggiore rispetto ai pesci adulti sviluppati esposti all'elemento in queste aree desolate. L'Oak Ridge National Laboratory ha dimostrato che gli embrioni di carpe e pesciolini cresciuti in soluzioni contenenti isotopi di plutonio non si schiudevano; le uova che si sono schiuse hanno mostrato anomalie significative rispetto agli embrioni sviluppati di controllo. Ha rivelato che è stato riscontrato che concentrazioni più elevate di plutonio causano problemi nella fauna marina esposta all'elemento.
Potenziale di criticità

Bisogna fare attenzione per evitare l'accumulo di quantità di plutonio che si avvicinano alla massa critica, in particolare perché la massa critica del plutonio è solo un terzo di quella dell'uranio-235. Una massa critica di plutonio emette quantità letali di neutroni e raggi gamma . È più probabile che il plutonio in soluzione formi una massa critica rispetto alla forma solida a causa della moderazione dell'idrogeno nell'acqua.
In passato si sono verificati incidenti critici , alcuni dei quali con conseguenze letali. La manipolazione incurante dei mattoni di carburo di tungsteno attorno a una sfera di plutonio da 6,2 kg provocò una dose fatale di radiazioni a Los Alamos il 21 agosto 1945, quando lo scienziato Harry Daghlian ricevette una dose stimata in 5,1 sievert (510 rem ) e morì 25 giorni dopo. Nove mesi dopo, un altro scienziato di Los Alamos, Louis Slotin , morì a causa di un incidente simile che coinvolse un riflettore al berillio e lo stesso nucleo di plutonio (il cosiddetto " nucleo del demone ") che aveva precedentemente causato la morte di Daghlian.
Nel dicembre 1958, durante un processo di purificazione del plutonio a Los Alamos, si formò una massa critica in un recipiente di miscelazione, che provocò la morte di un operatore chimico di nome Cecil Kelley . Altri incidenti nucleari si sono verificati in Unione Sovietica, Giappone, Stati Uniti e molti altri paesi.
Infiammabilità
Il plutonio metallico è un pericolo di incendio, specialmente se il materiale è finemente suddiviso. In un ambiente umido, il plutonio forma idruri sulla sua superficie, che sono piroforici e possono infiammarsi nell'aria a temperatura ambiente. Il plutonio si espande fino al 70% in volume mentre si ossida e quindi può rompere il suo contenitore. La radioattività del materiale in fiamme costituisce un ulteriore pericolo. La sabbia di ossido di magnesio è probabilmente il materiale più efficace per estinguere un incendio di plutonio. Raffredda il materiale in fiamme, fungendo da dissipatore di calore e blocca anche l'ossigeno. Sono necessarie precauzioni speciali per immagazzinare o manipolare il plutonio in qualsiasi forma; generalmente è richiesta un'atmosfera di gas inerte secco.
Trasporto
Terra e mare
Il normale trasporto del plutonio avviene attraverso l'ossido di plutonio più stabile in un pacchetto sigillato. Un trasporto tipico è costituito da un camion che trasporta un container di spedizione protetto, contenente un numero di pacchi con un peso totale variabile da 80 a 200 kg di ossido di plutonio. Una spedizione marittima può essere composta da diversi container, ognuno dei quali contiene un pacco sigillato. La Commissione di regolamentazione nucleare degli Stati Uniti stabilisce che deve essere solido anziché in polvere se il contenuto supera 0,74 TBq (20 Curie ) di attività radioattiva. Nel 2016, le navi Pacific Egret e Pacific Heron della Pacific Nuclear Transport Ltd. hanno trasportato 331 kg (730 libbre) di plutonio in una struttura del governo degli Stati Uniti a Savannah River , nella Carolina del Sud .
Aria
Le normative sul trasporto aereo del governo degli Stati Uniti consentono il trasporto di plutonio per via aerea, soggetto a restrizioni su altri materiali pericolosi trasportati sullo stesso volo, requisiti di imballaggio e stivaggio nella parte più arretrata dell'aeromobile.
Nel 2012 i media hanno rivelato che il plutonio è stato trasportato fuori dalla Norvegia su compagnie aeree passeggeri commerciali , circa ogni due anni, inclusa una volta nel 2011. I regolamenti consentono a un aereo di trasportare 15 grammi di materiale fissile. Tale trasporto di plutonio avviene senza problemi, secondo un consulente senior ( seniorrådgiver ) di Statens strålevern .
Appunti
Note a piè di pagina
Citazioni
Riferimenti
- Asimov, Isacco (1988). "Reattori nucleari". Capire la fisica . New York: Barnes & Noble Publishing. ISBN 0-88029-251-2.
- Bernstein, Jeremy (2007). Plutonio: una storia dell'elemento più pericoloso del mondo . Washington, DC: Joseph Henry Press. ISBN 978-0-309-10296-4. OCLC 76481517 .
- Clark, Ronald (1961). La nascita della bomba: la storia non raccontata della parte della Gran Bretagna nell'arma che ha cambiato il mondo . Londra: Casa Fenice. OCLC 824335 .
- Eagleson, Maria (1994). Chimica dell'enciclopedia concisa . Berlino: Walter de Gruyter. ISBN 978-3-11-011451-5.
- Emsley, Giovanni (2001). "Plutonio". Nature's Building Blocks: una guida dalla A alla Z agli elementi . Oxford (Regno Unito): Oxford University Press. ISBN 0-19-850340-7.
- Gosling, FG (1999). Il progetto Manhattan: realizzare la bomba atomica (PDF) . Oak Ridge: Dipartimento dell'Energia degli Stati Uniti. ISBN 0-7881-7880-6. DOE/MA-0001-01/99. Archiviata dall'originale (PDF) il 24 febbraio 2009 . Estratto il 15 febbraio 2009 .
- Greenwood, NN; Earnshaw, A. (1997). Chimica degli elementi (2a ed.). Oxford (Regno Unito): Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Heisermann, David L. (1992). "Elemento 94: plutonio" . Esplorare gli elementi chimici e i loro composti . New York (NY): TAB Libri. pp. 337–340 . ISBN 0-8306-3018-X.
- Hoddeson, Lilian ; Henriksen, Paul W.; Meade, Roger A.; Westfall, Catherine L. (1993). Assemblea critica: una storia tecnica di Los Alamos durante gli anni di Oppenheimer, 1943-1945 . New York: Pressa dell'Università di Cambridge. ISBN 0-521-44132-3. OCLC 26764320 .
- Hunner, Jon (2004). Inventare Los Alamos . ISBN 978-0-8061-3891-6.
- Hurst, DG; Rione, AG (1956). Reattori di ricerca canadesi (PDF) . Ottawa: Energia atomica del Canada limitata. OCLC 719819357 . Archiviato (PDF) dall'originale il 5 febbraio 2015 . Estratto il 6 febbraio 2015 .
- Jha, Danimarca (2004). Energia nucleare . Casa editrice Scoperta. ISBN 81-7141-884-8. Archiviata dall'originale il 6 gennaio 2022 . Estratto il 6 gennaio 2022 .
- Kaku, Michio; Allenatore, Jennifer (1983). Energia nucleare, entrambe le parti: i migliori argomenti a favore e contro la tecnologia più controversa . W.W. Norton & Company. ISBN 9780393301281. Archiviata dall'originale il 6 gennaio 2022 . Estratto l'8 dicembre 2013 .
- Kay, AA (1965). plutonio 1965 . Taylor e Francesco. Archiviata dall'originale il 6 gennaio 2022 . Estratto il 6 gennaio 2022 .
- Lide, David R., ed. (2006). Manuale di chimica e fisica (87a ed.). Boca Raton: CRC Press, Gruppo Taylor & Francis. ISBN 0-8493-0487-3.
- Magurno, BA; Pearlstein, S., eds. (1981). Atti del convegno sui metodi e le procedure di valutazione dei dati nucleari. BNL-NCS 51363 (PDF) . vol. II. Upton: Laboratorio nazionale di Brookhaven . Archiviato (PDF) dall'originale l'8 marzo 2021 . Estratto il 6 agosto 2014 .
- Martin, James E. (2000). Fisica per la protezione dalle radiazioni . Wiley-Interscience. ISBN 0-471-35373-6.
- McLaughlin, Thomas P.; Monahan, Shean P.; Pruvost, Norman L. (2000). Una revisione degli incidenti critici (PDF) . Los Alamos: Laboratorio nazionale di Los Alamos. LA-13638. Archiviato (PDF) dall'originale il 18 gennaio 2017 . Estratto il 6 febbraio 2015 .
- Minatore, William N.; Schönfeld, Fred W. (1968). "Plutonio" . In Clifford A. Hampel (a cura di). L'enciclopedia degli elementi chimici . New York (NY): Reinhold Book Corporation. pp. 540–546 . LCCN 68029938 .
- Moody, Kenton James; Hutcheon, Ian D.; Concessione, Patrick M. (2005). Analisi forense nucleare . C.R.C. Press. ISBN 0-8493-1513-1. Archiviata dall'originale il 6 gennaio 2022 . Estratto il 6 gennaio 2022 .
- Rodi, Richard (1986). La realizzazione della bomba atomica . New York: Simon & Schuster. ISBN 0-671-65719-4.
- Seaborg, GT; Seaborg, E. (2001). Avventure nell'era atomica: da Watts a Washington . Farrar, Straus e Giroux. ISBN 0-374-29991-9.
- Sklar, Morti (1984). Nuke-Rebuke: scrittori e artisti contro l'energia nucleare e le armi . La collana antologica contemporanea. Lo spirito che ci muove Premere.
- Istituto internazionale di ricerca sulla pace di Stoccolma (2007). Annuario SIPRI 2007: Armamenti, disarmo e sicurezza internazionale . La stampa dell'università di Oxford. ISBN 978-0-19-923021-1. Archiviata dall'originale il 6 gennaio 2022 . Estratto il 6 gennaio 2022 .
- Fino a, CE; Chang, Yi (2011). Energia abbondante: la storia del reattore veloce integrale, la storia complessa di una tecnologia di reattore semplice, con enfasi sulla sua base scientifica per i non specialisti . Charles E. Till e Yoon Il Chang. ISBN 978-1-4663-8460-6.
- Wahlen, RK (1989). Storia dell'Area 100-B (PDF) . Richland, Washington: Compagnia Westinghouse Hanford. WHC-EP-0273. Archiviata dall'originale (PDF) il 27 marzo 2009 . Estratto il 15 febbraio 2009 .
- Benvenuta, Eileen (2000). I file di plutonio: esperimenti medici segreti americani nella guerra fredda . New York: casa casuale. ISBN 0-385-31954-1.
link esterno
- "Alsos Biblioteca digitale per le questioni nucleari - Plutonio" . Università di Washington e Lee . Archiviata dall'originale il 3 febbraio 2009 . Estratto il 15 febbraio 2009 .
- Sutcliffe, WG; et al. (1995). "Una prospettiva sui pericoli del plutonio" . Laboratorio Nazionale Lawrence Livermore . Archiviata dall'originale il 29 settembre 2006.
- "Proprietà fisiche, nucleari e chimiche del plutonio" . IER . 2005 . Estratto il 15 febbraio 2009 .
- Bhadeshia, H. "Cristallografia del plutonio" .
- Samuels, D. (2005). "Fine dell'era del plutonio" . Scopri la rivista . 26 (11).
- Picca, J.; Sherman, R. (2000). "Produzione di plutonio" . Federazione degli scienziati americani . Archiviata dall'originale il 3 febbraio 2009 . Estratto il 15 febbraio 2009 .
- "Fabbricazione e fabbricazione di plutonio" .
- Ong, C. (1999). "Inventari mondiali di plutonio" . File nucleari.org. Archiviata dall'originale il 5 agosto 2014 . Estratto il 15 febbraio 2009 .
- "Sfide nella scienza del plutonio" . Scienza di Los Alamos . I e II (26). 2000 . Estratto il 15 febbraio 2009 .
- "Plutonio" . Società Reale di Chimica . Estratto il 6 febbraio 2015 .
- "Plutonio" . La tavola periodica dei video . Università di Nottingham . Estratto il 6 febbraio 2015 .


![{\displaystyle {\ce {{^{238}_{92}U}+{^{1}_{0}n}->{^{239}_{92}U}->[\beta ^{ -}][23.5\ {\ce {min}}]{^{239}_{93}Np}->[\beta ^{-}][2.3565\ {\ce {d}}]{^{239 }_{94}Pu}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9ba9e4744226a97ce8a41fd5b5e50b18cc259a9)
![{\displaystyle {\begin{allineato}{\ce {{^{238}_{92}U}+{^{2}_{1}RE}->}}&{\ce {{^{238} _{93}Np}+2_{0}^{1}n}}\\&{\ce {^{238}_{93}Np->[\beta ^{-}][2.117\ {\ce {d}}]{^{238}_{94}Pu}}}\end{allineato}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1b584c932e52212178b2befe7a512a7b28f87d35)