Rimonabant - Rimonabant
 | |
 | |
| Dati clinici | |
|---|---|
| AHFS / Drugs.com | Informazioni sui farmaci per i consumatori |
| Dati della licenza | |
Categoria di gravidanza |
|
| Vie di somministrazione |
Orale |
| Codice ATC | |
| Status giuridico | |
| Status giuridico | |
| Dati farmacocinetici | |
| Biodisponibilità | Indeterminato |
| Legame proteico | Quasi il 100% |
| Metabolismo | Epatico , CYP3A4 coinvolto |
| Eliminazione emivita | Variabile: da 6 a 9 giorni con BMI normale 16 giorni se BMI> 30 |
| Escrezione | Fecale (86%) e renale (3%) |
| Identificatori | |
| |
| Numero CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard ( EPA ) | |
| Scheda informativa ECHA |
100.210.978 |
| Dati chimici e fisici | |
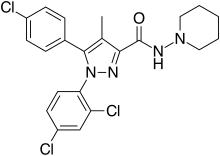
| Formula | C 22 H 21 Cl 3 N 4 O |
| Massa molare | 463,79 g · mol −1 |
| Modello 3D ( JSmol ) | |
| |
| |
| (verificare) | |
Rimonabant (noto anche come SR141716 ; nomi commerciali Acomplia , Zimulti ) è un farmaco antiobesità anoressico che è stato approvato per la prima volta in Europa nel 2006 ma è stato ritirato in tutto il mondo nel 2008 a causa di gravi effetti collaterali psichiatrici; non è mai stato approvato negli Stati Uniti. Rimonabant è un agonista inverso per il recettore dei cannabinoidi CB 1 ed è stato il primo farmaco approvato in quella classe.
Storia
Rimonabant è un bloccante selettivo del recettore CB 1 ed è stato scoperto e sviluppato da Sanofi-Aventis ;
Il 21 giugno 2006, la Commissione Europea ha approvato la vendita di rimonabant nell'Unione Europea di allora 25 membri come farmaco da prescrizione per l'uso in combinazione con dieta ed esercizio fisico per pazienti con un indice di massa corporea (BMI) superiore a 30 kg / m 2 , o pazienti con un BMI maggiore di 27 kg / m 2 con fattori di rischio associati, come il diabete di tipo 2 o la dislipidemia . È stato il primo della sua categoria ad essere approvato in qualsiasi parte del mondo.
Rimonabant è stato sottoposto all'approvazione della Food and Drug Administration (FDA) negli Stati Uniti nel 2005; nel 2007, l'Endocrine and Metabolic Drugs Advisory Committee (EMDAC) della FDA ha concluso che Sanofi-Aventis non è riuscita a dimostrare la sicurezza di rimonabant e ha votato contro la raccomandazione del trattamento anti-obesità per l'approvazione e due settimane dopo la società ha ritirato la domanda.
Il farmaco è stato approvato in Brasile nell'aprile 2007.
Nell'ottobre 2008, l' Agenzia europea per i medicinali ha raccomandato la sospensione di Acomplia dopo che il comitato per i medicinali per uso umano (CHMP) aveva stabilito che i rischi di Acomplia superavano i suoi benefici a causa del rischio di gravi problemi psichiatrici, incluso il suicidio. Nel novembre 2008 anche un comitato consultivo in Brasile ha raccomandato la sospensione e quel mese Sanofi-Aventis ha sospeso la vendita del farmaco in tutto il mondo. L'approvazione dell'EMA è stata ritirata nel gennaio 2009. Nel 2009 l'India ha vietato la produzione e la vendita del farmaco.
Effetti collaterali
I dati provenienti da studi clinici presentati alle autorità regolatorie hanno mostrato che rimonabant causava disturbi depressivi o alterazioni dell'umore fino al 10% dei soggetti e ideazione suicidaria in circa l'1%, e in Europa era controindicato per le persone con qualsiasi disturbo psichiatrico, compresi gli individui depressi o suicidi .
Inoltre, la nausea e le infezioni del tratto respiratorio superiore erano effetti avversi molto comuni (che si sono verificati in più del 10% delle persone); effetti avversi comuni (che si verificano tra l'1% e il 10% delle persone) includevano gastroenterite , ansia, irritabilità, insonnia e altri disturbi del sonno, vampate di calore, diarrea, vomito, pelle secca o pruriginosa, tendiniti, crampi muscolari e spasmi, affaticamento, influenza sintomi simili e aumento del rischio di cadute.
Il comitato consultivo della FDA ha sollevato la preoccupazione che, sulla base dei dati sugli animali, sembrava che la finestra terapeutica per quanto riguarda la tossicità del SNC, e in particolare le convulsioni, fosse quasi inesistente; la dose terapeutica e la dose che ha causato convulsioni negli animali sembravano essere la stessa.
Quando l'EMA ha esaminato i dati di sorveglianza post-marketing , ha scoperto che il rischio di disturbi psichiatrici nelle persone che assumevano rimonabant era raddoppiato.
Chimica
La sintesi chimica di rimonabant è descritta come segue:
Ricerca
Insieme agli studi clinici sull'obesità che hanno generato i dati presentati alle autorità di regolamentazione, rimonabant è stato studiato anche negli studi clinici come potenziale trattamento per altre condizioni, tra cui diabete, aterosclerosi e smettere di fumare.

