Elettroforesi delle proteine sieriche - Serum protein electrophoresis
| Elettroforesi delle proteine del siero | |
|---|---|
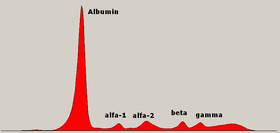 Diagramma normale dell'elettroforesi delle proteine sieriche con legenda delle diverse zone.
| |
| Maglia | D001797 |

L'elettroforesi delle proteine sieriche ( SPEP o SPE ) è un test di laboratorio che esamina proteine specifiche nel sangue chiamate globuline . Le indicazioni più comuni per un test di elettroforesi delle proteine sieriche sono diagnosticare o monitorare il mieloma multiplo , una gammapatia monoclonale di significato incerto (MGUS), o indagare ulteriormente su una discrepanza tra una bassa albumina e una proteina totale relativamente alta. Anche dolore osseo inspiegabile, anemia, proteinuria , malattia renale cronica e ipercalcemia sono segni di mieloma multiplo e indicazioni per SPE. Il sangue deve essere prima raccolto, di solito in una fiala o una siringa ermetica . L'elettroforesi è una tecnica di laboratorio in cui il siero sanguigno (la porzione fluida del sangue dopo che il sangue si è coagulato) viene applicato su una membrana di acetato imbevuta di un tampone liquido, o su una matrice di gel di agarosio tamponata , o in un liquido in un capillare tubo ed esposto a una corrente elettrica per separare i componenti della proteina del siero in cinque frazioni principali per dimensione e carica elettrica: albumina sierica , alfa-1 globuline , alfa-2 globuline , beta 1 e 2 globuline e gamma globuline .
Elettroforesi su acetato o gel
Le proteine sono separate sia da forze elettriche che da forze elettroendoosmostiche. La carica netta su una proteina si basa sulla carica somma dei suoi amminoacidi e sul pH del tampone. Le proteine vengono applicate a una matrice solida come un gel di agarosio o una membrana di acetato di cellulosa in un tampone liquido e viene applicata corrente elettrica. Le proteine con carica negativa migreranno verso l'anodo con carica positiva. L'albumina ha la carica più negativa e migrerà più lontano verso l'anodo. Il flusso endoosmotico è il movimento del liquido verso il catodo, che fa sì che le proteine con una carica più debole si spostino all'indietro dal sito di applicazione. Le proteine gamma sono principalmente separate da forze endoosmotiche.
Elettroforesi capillare
Nell'elettroforesi capillare, non esiste una matrice solida. Le proteine sono separate principalmente da forti forze elettroendoosmotiche. Il campione viene iniettato in un capillare con carica superficiale negativa. Viene applicata una corrente elevata e proteine caricate negativamente come l'albumina cercano di spostarsi verso l'anodo. Il tampone liquido scorre verso il catodo e trascina le proteine con una carica più debole.
Frazioni proteiche sieriche
Albumina
L'albumina è la frazione maggiore in un normale SPEP. È necessaria una diminuzione del 30% prima che la diminuzione si manifesti sull'elettroforesi. Di solito si vede una singola banda. Gli individui eterozigoti possono produrre bisalbuminemia - due bande ugualmente colorate , il prodotto di due geni. Alcune varianti danno origine a una banda larga oa due bande di diversa intensità, ma nessuna di queste varianti è associata a malattia. L'aumento della mobilità anodica deriva dal legame della bilirubina , degli acidi grassi non esterificati , della penicillina e dell'acido acetilsalicilico e, occasionalmente, dalla digestione triptica nella pancreatite acuta .
L'assenza di albumina, nota come analbuminemia , è rara. Un livello ridotto di albumina, tuttavia, è comune in molte malattie, comprese le malattie del fegato , la malnutrizione , il malassorbimento, la nefropatia con perdita di proteine e l'enteropatia.
Albumina – interzona alfa-1
Anche la colorazione in questa zona è dovuta alla lipoproteina alfa-1 (lipoproteina ad alta densità – HDL). La diminuzione si verifica in caso di infiammazione grave, epatite acuta e cirrosi . Inoltre, la sindrome nefrosica può portare a una diminuzione del livello di albumina; a causa della sua perdita nelle urine attraverso un glomerulo che perde danneggiato . Un aumento appare negli alcolisti gravi e nelle donne durante la gravidanza e la pubertà.
Gli alti livelli di AFP che possono verificarsi nel carcinoma epatocellulare possono provocare una banda netta tra l'albumina e la zona alfa-1.
Zona alfa-1
L'orosomucoid e l' antitripsina migrano insieme ma l'orosomucoid si colora male, quindi l' alfa 1 antitripsina (AAT) costituisce la maggior parte della banda alfa-1. L'alfa-1 antitripsina ha un gruppo SG e i composti tiolici possono essere legati alla proteina alterandone la mobilità. Nello stato di carenza si osserva una banda ridotta. È diminuito nella sindrome nefrosica e l'assenza potrebbe indicare un possibile deficit di alfa 1-antitripsina. Questo alla fine porta all'enfisema dovuto all'attività non regolata dell'elastasi neutrofila nel tessuto polmonare. La frazione alfa-1 non scompare nel deficit di alfa 1-antitripsina, tuttavia, perché anche altre proteine, tra cui alfa- lipoproteina e orosomucoide, migrano lì. Come reagente di fase acuta positivo, l'AAT è aumentato nell'infiammazione acuta.
La proteina di Bence Jones può legarsi e ritardare la banda alfa-1.
Interzona alfa-1 – alfa-2
Si possono osservare due deboli bande che rappresentano l' alfa 1-antichimotripsina e la proteina legante la vitamina D. Queste bande si fondono e si intensificano all'inizio dell'infiammazione a causa di un aumento dell'alfa 1-antichimotripsina, una proteina della fase acuta .
Zona alfa-2
Questa zona è costituita principalmente da alfa-2 macroglobulina (AMG o A2M) e aptoglobina . Ci sono tipicamente bassi livelli nell'anemia emolitica (l'aptoglobina è una molecola suicida che si lega all'emoglobina libera rilasciata dai globuli rossi e questi complessi vengono rapidamente rimossi dai fagociti ). L'aptoglobina viene sollevata come parte della risposta della fase acuta, determinando un tipico innalzamento della zona alfa-2 durante l'infiammazione. Una normale zona alfa-2 e una zona alfa-1 elevata è un modello tipico nelle metastasi epatiche e nella cirrosi.
I complessi aptoglobina/emoglobina migrano più catodalmente dell'aptoglobina come si osserva nell'interzona alfa-2-beta. Questo è tipicamente visto come un allargamento della zona alfa-2.
La macroglobulina alfa-2 può essere elevata nei bambini e negli anziani. Questo è visto come un fronte netto alla banda alfa-2. L'AMG è notevolmente aumentata (aumento di 10 volte o più) in associazione con la perdita di proteine glomerulari, come nella sindrome nefrosica . A causa delle sue grandi dimensioni, l'AMG non può passare attraverso i glomeruli, mentre altre proteine a basso peso molecolare vengono perse. La sintesi potenziata di AMG spiega il suo aumento assoluto nella sindrome nefrosica. Un aumento dell'AMG è stato notato anche nei ratti senza albumina, indicando che questa è una risposta a un basso livello di albumina piuttosto che alla stessa sindrome nefrosica
L'AMG è lievemente elevata all'inizio della nefropatia diabetica .
Alfa-2 - beta interzona
La globulina insolubile a freddo forma qui una banda che non si vede nel plasma perché è precipitata dall'eparina . Ci sono bassi livelli di infiammazione e alti livelli in gravidanza.
La beta lipoproteina forma una banda crenata irregolare in questa zona. Alti livelli sono visti in tipo II ipercolesterolemia , ipertrigliceridemia , e nella sindrome nefrosica.
Zona beta
La transferrina e la beta-lipoproteina ( LDL ) comprendono la beta-1. L'aumento della proteina beta-1 dovuto all'aumento del livello di transferrina libera è tipico dell'anemia sideropenica , della gravidanza e della terapia con estrogeni . L'aumento della proteina beta-1 dovuto all'aumento delle LDL si verifica nell'ipercolesterolemia . La diminuzione della proteina beta-1 si verifica nell'infiammazione acuta o cronica.
Beta-2 comprende C3 ( proteina 3 del complemento ). Viene sollevato nella risposta della fase acuta. La depressione di C3 si verifica nelle malattie autoimmuni quando il sistema del complemento viene attivato e il C3 si lega agli immunocomplessi e viene rimosso dal siero. Il fibrinogeno, una proteina beta-2, si trova nel plasma normale ma è assente nel siero normale. Occasionalmente, il sangue prelevato da pazienti eparinizzati non coagula completamente, determinando una banda di fibrinogeno visibile tra le beta e le gamma globuline.
Interzona beta-gamma
La proteina C-reattiva si trova tra le zone beta e gamma producendo la fusione beta/gamma. L'IgA ha la mobilità più anodica e tipicamente migra nella regione tra le zone beta e gamma causando anche una fusione beta/gamma in pazienti con cirrosi, infezioni respiratorie, malattie della pelle o artrite reumatoide (aumento di IgA). Il fibrinogeno da campioni di plasma sarà visto nella regione beta gamma. Il fibrinogeno, una proteina beta-2, si trova nel plasma normale ma è assente nel siero normale. Occasionalmente, il sangue prelevato da pazienti eparinizzati non coagula completamente, determinando una banda di fibrinogeno visibile tra le beta e le gamma globuline.
Zona gamma
Le immunoglobuline o anticorpi sono generalmente le uniche proteine presenti nella normale regione gamma. Da notare, qualsiasi proteina che migra nella regione gamma sarà macchiata e apparirà sul gel, che potrebbe includere contaminanti proteici, artefatti o determinati farmaci. A seconda che si utilizzi un metodo di agarosio o capillare, le interferenze variano. Le immunoglobuline sono costituite da catene pesanti (IgA, IgM, IgG, IgE e IgD) e catene leggere (kappa e lambda). Una normale zona gamma dovrebbe apparire come un "arrossamento" uniforme, o una macchia, senza asimmetria o picchi acuti. Le gamma globuline possono essere elevate ( ipergammaglobulinemia ), diminuite ( ipogammaglobulinemia ) o avere un picco o picchi anormali. Si noti che le immunoglobuline possono essere trovate anche in altre zone; Le IgA tipicamente migrano nella zona beta-gamma e, in particolare, le immunoglobuline patogene possono migrare ovunque, comprese le regioni alfa.
L'ipogammaglobulinemia è facilmente identificabile come un "crollo" o diminuzione della zona gamma. È normale nei neonati. Si trova in pazienti con agammaglobulinemia legata all'X . La carenza di IgA si verifica in 1:500 della popolazione, come suggerisce un pallore nella zona gamma. Da notare, l'ipogammaglobulinema può essere visto nel contesto della MGUS o del mieloma multiplo.
Se la zona gamma mostra un aumento, il primo passo nell'interpretazione è stabilire se la regione è stretta o larga. Un ampio modo "simile a rigonfiamento" (ampio) indica la produzione di immunoglobuline policlonali. Se è elevato in modo asimmetrico o con uno o più picchi o "spicchi" stretti potrebbe indicare la produzione clonale di una o più immunoglobuline,
La gammapatia policlonale è indicata da un'elevazione "simile a un rigonfiamento" nella zona gamma, che tipicamente indica una condizione non neoplastica (sebbene non sia esclusiva delle condizioni non neoplastiche). Le cause più comuni di ipergammaglobulinemia policlonale rilevate dall'elettroforesi sono infezioni gravi , malattie epatiche croniche, artrite reumatoide, lupus eritematoso sistemico e altre malattie del tessuto connettivo.
Un picco stretto è indicativo di una gammapatia monoclonale, nota anche come banda ristretta o "M-spike". Per confermare che la banda ristretta è un'immunoglobulina, eseguire test di follow-up con immunofissazione o immunospostamento/immunosottrazione (metodi capillari). Anche gli anticorpi monoclonali terapeutici (mAb), migrano in questa regione e possono essere interpretati erroneamente come gammopatia monoclonale e possono anche essere identificati mediante immunofissazione o immunospostamento/immunosottrazione poiché sono strutturalmente paragonabili alle immunoglobuline umane. La causa più comune di una banda ristretta è una MGUS (gammopatia monoclonale di significato incerto), che, sebbene sia un precursore necessario, solo raramente evolve in mieloma multiplo. (In media, 1%/anno.) Tipicamente, una gammapatia monoclonale è di origine maligna o clonale, essendo il mieloma la causa più comune di picchi di IgA e IgG . la leucemia linfatica cronica e il linfosarcoma non sono rari e di solito danno origine a paraproteine IgM . Si noti che fino all'8% dei pazienti geriatrici sani può avere un picco monoclonale. Anche la macroglobulinemia di Waldenström (IgM), la gammapatia monoclonale di significato indeterminato (MGUS), l'amiloidosi, la leucemia plasmacellulare e i plasmocitomi solitari producono un picco M.
La gammapatia oligoclonale è indicata da uno o più cloni discreti.
Il lisozima può essere visto come una banda catodica rispetto al gamma nella leucemia mielomonocitica in cui viene rilasciato dalle cellule tumorali .
Riferimenti
link esterno
- Elettroforesi proteica a Lab Tests Online

