Tetraioduro di carbonio - Carbon tetraiodide
|
|||

|
|||
|
|
|||
| nomi | |||
|---|---|---|---|
|
Nome IUPAC preferito
Tetraiodometano |
|||
| Identificatori | |||
|
Modello 3D ( JSmol )
|
|||
| 1733108 | |||
| ChemSpider | |||
| Scheda informativa dell'ECHA |
100.007.335 |
||
| Numero CE | |||
|
PubChem CID
|
|||
| Numero RTECS | |||
| UNII | |||
|
Cruscotto CompTox ( EPA )
|
|||
|
|||
|
|||
| Proprietà | |||
| DO I 4 | |||
| Massa molare | 519.629 g·mol −1 | ||
| Aspetto esteriore | Cristalli viola scuro | ||
| Densità | 4,32 g ml −1 | ||
| -136·10 −6 cm 3 /mol | |||
| Struttura | |||
| tetragonale | |||
| tetraedrico | |||
| 0 D | |||
| Termochimica | |||
|
Capacità termica ( C )
|
0,500 JK −1 g −1 | ||
|
Entalpia standard di
formazione (Δ f H ⦵ 298 ) |
384,0–400,4 kJ mol −1 | ||
|
Entalpia standard di
combustione (Δ c H ⦵ 298 ) |
−794.4–−778.4 kJ mol −1 | ||
| Pericoli | |||
| Pittogrammi GHS |

|
||
| Avvertenza GHS | Avvertimento | ||
| H315 , H319 , H335 | |||
| P261 , P305+351+338 | |||
| Composti correlati | |||
|
Altri anioni
|
Tetrafluoruro di carbonio Tetracloruro di carbonio Tetrabromuro di carbonio |
||
|
Altri cationi
|
Tetraioduro di silicio Tetraioduro di germanio Ioduro di stagno (IV) |
||
|
Alcani correlati
|
|||
|
Composti correlati
|
|||
|
Salvo indicazione contraria, i dati sono forniti per i materiali nel loro stato standard (a 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Riferimenti alla casella informativa | |||
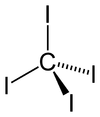
Il tetraioduro di carbonio è un tetraalometano con la formula molecolare CI 4 . Essendo rosso vivo, è un esempio relativamente raro di un derivato del metano molto colorato . È solo il 2% in peso di carbonio, sebbene siano noti altri derivati del metano con ancora meno carbonio.
Struttura
La molecola tetraedrica presenta distanze CI di 2,12 ± 0,02 . La molecola è leggermente affollata con brevi contatti tra atomi di iodio di 3,459 ± 0,03 , e forse per questo motivo è termicamente e fotochimicamente instabile.
Il tetraioduro di carbonio cristallizza in una struttura cristallina tetragonale ( a 6.409, c 9.558 (.10 -1 nm)).
Ha momento di dipolo nullo a causa della sua molecola tetraedrica sostituita simmetricamente .
Proprietà, sintesi, usi
Il tetraioduro di carbonio è leggermente reattivo verso l'acqua, dando iodoformio e I 2 . È solubile in solventi organici non polari. Si decompone termicamente e fotochimicamente in tetraiodoetilene , C 2 I 4 . La sua sintesi prevede uno scambio di alogenuri catalizzato da AlCl 3 , che viene condotto a temperatura ambiente:
Il prodotto cristallizza dalla soluzione di reazione.
Il tetraioduro di carbonio viene utilizzato come reagente di iodurazione , spesso per reazione con basi. I chetoni vengono convertiti in 1,1-diiodoalcheni dopo trattamento con trifenilfosfina (PPh 3 ) e tetraioduro di carbonio. Gli alcoli vengono convertiti in e in ioduro, mediante un meccanismo simile alla reazione di Appel . In una reazione di Appel, il tetracloruro di carbonio viene utilizzato per generare cloruri alchilici dagli alcoli.
Considerazioni sulla sicurezza
I produttori raccomandano di conservare il tetraioduro di carbonio vicino a 0 °C (32 °F). Come fonte pronta di iodio, è irritante. Il suo LD 50 è 178 mg.kg -1 . In generale, i composti organici peralogenati dovrebbero essere considerati tossici, con la stretta eccezione dei piccoli perfluoroalcani (essenzialmente inerti a causa della forza del legame CF).
Riferimenti
Ulteriori letture
- Sorros H., Hinkam JB (1945). "La reazione di ridistribuzione. XI. Applicazione alla preparazione di tetraioduro di carbonio e alogenuri correlati". Giornale della società chimica americana . 67 : 1643. doi : 10.1021/ja01226a004 .



