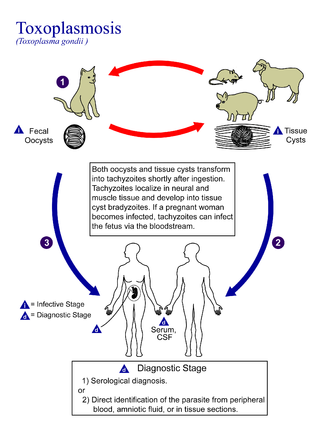
Toxoplasmosi -Toxoplasmosis
| Toxoplasmosi | |
|---|---|
 | |
| T. gondii tachizoiti | |
| Specialità | Malattia infettiva |
| Sintomi | Spesso nessuno, durante la gravidanza (difetti congeniti) |
| Cause | Toxoplasma gondii |
| Fattori di rischio | Mangiare cibo poco cotto, esposizione a feci di gatto infette |
| Metodo diagnostico | Analisi del sangue, test del liquido amniotico |
| Trattamento | Durante la gravidanza spiramicina o pirimetamina / sulfadiazina e acido folinico |
| Frequenza | Fino al 50% delle persone, 200.000 casi di toxoplasmosi congenita all'anno |
La toxoplasmosi è una malattia parassitaria causata dal Toxoplasma gondii , un apicomplexan . Le infezioni da toxoplasmosi sono associate a una varietà di condizioni neuropsichiatriche e comportamentali. Occasionalmente, le persone possono avere alcune settimane o mesi di lieve malattia simil-influenzale come dolori muscolari e linfonodi dolenti . In un piccolo numero di persone, possono svilupparsi problemi agli occhi. In quelli con un sistema immunitario debole , possono verificarsi sintomi gravi come convulsioni e scarsa coordinazione. Se una persona viene infettata durante la gravidanza , una condizione nota come toxoplasmosi congenita può colpire il bambino.
La toxoplasmosi di solito si diffonde mangiando cibi poco cotti che contengono cisti , esposizione a feci di gatto infette e da una donna infetta al loro bambino durante la gravidanza. Raramente, la malattia può essere trasmessa tramite trasfusione di sangue . Non è altrimenti diffuso tra le persone. È noto che il parassita si riproduce sessualmente solo nella famiglia dei gatti . Tuttavia, può infettare la maggior parte dei tipi di animali a sangue caldo , compresi gli esseri umani. La diagnosi è in genere testando il sangue per gli anticorpi o testando il liquido amniotico in una paziente incinta per il DNA del parassita .
La prevenzione è preparando e cucinando correttamente il cibo. Si raccomanda inoltre alle donne incinte di non pulire le lettiere dei gatti o, se necessario, di indossare guanti e lavarsi le mani dopo. Il trattamento di persone altrimenti sane di solito non è necessario. Durante la gravidanza, per il trattamento possono essere utilizzati spiramicina o pirimetamina / sulfadiazina e acido folinico .
Fino alla metà della popolazione mondiale è infettata da T. gondii , ma non presenta sintomi. Negli Stati Uniti, circa l'11% delle persone è stato infettato, mentre in alcune aree del mondo questo supera il 60%. Ogni anno si verificano circa 200.000 casi di toxoplasmosi congenita. Charles Nicolle e Louis Manceaux descrissero per la prima volta l'organismo nel 1908. Nel 1941 fu confermata la trasmissione durante la gravidanza da una madre incinta al loro bambino. Ci sono prove provvisorie che l'infezione possa influenzare il comportamento delle persone.
segni e sintomi
L'infezione ha tre fasi:
Acuto
La toxoplasmosi acuta è spesso asintomatica negli adulti sani. Tuttavia, i sintomi possono manifestarsi e sono spesso simili all'influenza : linfonodi ingrossati , mal di testa, febbre e affaticamento o dolori muscolari che durano per un mese o più. È raro che un essere umano con un sistema immunitario perfettamente funzionante sviluppi sintomi gravi a seguito di un'infezione. Le persone con un sistema immunitario indebolito possono soffrire di mal di testa, confusione, scarsa coordinazione, convulsioni, problemi polmonari che possono assomigliare alla tubercolosi o alla polmonite da Pneumocystis jiroveci (una comune infezione opportunistica che si verifica nelle persone con AIDS) o corioretinite causata da una grave infiammazione della retina (toxoplasmosi oculare). I bambini piccoli e le persone immunocompromesse , come quelli con HIV/AIDS, coloro che assumono determinati tipi di chemioterapia o coloro che hanno recentemente ricevuto un trapianto di organi , possono sviluppare una grave toxoplasmosi. Ciò può causare danni al cervello ( encefalite ) o agli occhi ( retinocoroidite necrotizzante ). I neonati infettati tramite trasmissione placentare possono nascere con uno di questi problemi o con malformazioni nasali, sebbene queste complicanze siano rare nei neonati. I trofozoiti toxoplasmatici che causano la toxoplasmosi acuta sono indicati come tachizoiti e si trovano tipicamente in vari tessuti e fluidi corporei, ma raramente nel sangue o nel liquido cerebrospinale.
I linfonodi ingrossati si trovano comunemente nel collo o sotto il mento, seguiti dalle ascelle e dall'inguine. Il gonfiore può manifestarsi in tempi diversi dopo l'infezione iniziale, persistere e ripresentarsi per tempi diversi indipendentemente dal trattamento antiparassitario. Di solito si trova in singoli siti negli adulti, ma nei bambini possono essere più comuni siti multipli. I linfonodi ingrossati si risolvono entro 1-2 mesi nel 60% dei casi. Tuttavia, un quarto delle persone colpite impiega 2-4 mesi per tornare alla normalità e l'8% impiega 4-6 mesi. Un numero considerevole (6%) torna alla normalità solo molto più tardi.
Latente
A causa dell'assenza di sintomi evidenti, gli ospiti si infettano facilmente con T. gondii e sviluppano la toxoplasmosi senza saperlo. Sebbene occasionalmente si verifichino lievi sintomi simil-influenzali durante le prime settimane successive all'esposizione, l'infezione da T. gondii non produce sintomi prontamente osservabili negli adulti umani sani. Nella maggior parte delle persone immunocompetenti , l'infezione entra in una fase latente, durante la quale sono presenti solo bradizoiti ( nelle cisti tissutali ); queste cisti tissutali e persino lesioni possono verificarsi nelle retine , nel rivestimento alveolare dei polmoni (dove un'infezione acuta può simulare un'infezione da Pneumocystis jirovecii ), nel cuore, nel muscolo scheletrico e nel sistema nervoso centrale (SNC), compreso il cervello. Le cisti si formano nel sistema nervoso centrale ( tessuto cerebrale ) dopo l'infezione da T. gondii e persistono per tutta la vita dell'ospite. La maggior parte dei bambini infetti mentre sono nel grembo materno non presentano sintomi alla nascita, ma possono svilupparli più tardi nella vita.
Le revisioni degli studi sierologici hanno stimato che il 30-50% della popolazione mondiale è stata esposta e potrebbe essere cronicamente infettata da toxoplasmosi latente, sebbene i tassi di infezione differiscano significativamente da paese a paese. Questo stato latente di infezione è stato recentemente associato a numerosi carichi di malattia , alterazioni neurali e sottili cambiamenti comportamentali dipendenti dal genere negli esseri umani immunocompetenti, nonché un aumento del rischio di collisioni con veicoli a motore.
Pelle
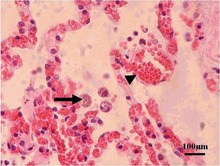
Sebbene rare, nella forma acquisita della malattia possono verificarsi lesioni cutanee, tra cui eruzioni simili a roseola ed eritema multiforme, noduli simili a prurigo , orticaria e lesioni maculopapulari . I neonati possono presentare macchie puntiformi , ecchimosi o lesioni "muffin ai mirtilli". La diagnosi di toxoplasmosi cutanea si basa sulla presenza della forma tachizoita di T. gondii nell'epidermide . Si trova in tutti i livelli dell'epidermide, misura circa 6 x 2 μm ed è a forma di arco, con il nucleo che è un terzo delle sue dimensioni. Può essere identificato mediante microscopia elettronica o mediante colorazione Giemsa del tessuto in cui il citoplasma è blu, il nucleo rosso.
Causa
Parassitologia
Nel suo ciclo di vita, T. gondii adotta diverse forme. I tachizoiti sono responsabili dell'infezione acuta; si dividono rapidamente e si diffondono attraverso i tessuti del corpo. I tachizoiti sono anche conosciuti come "merozoiti tachizoici", termine descrittivo che esprime più precisamente la natura parassitologica di questo stadio. Dopo la proliferazione, i tachizoiti si convertono in bradizoiti , che si trovano all'interno di cisti di tessuto intracellulare latente che si formano principalmente nei muscoli e nel cervello. La formazione delle cisti è in parte innescata dalla pressione del sistema immunitario dell'ospite. I bradizoiti (chiamati anche "merozoiti bradizoici") non rispondono agli antibiotici. I bradizoiti, una volta formati, possono rimanere nei tessuti per tutta la durata della vita dell'ospite. In un ospite sano, se alcuni bradizoiti si riconvertono in tachizoiti attivi, il sistema immunitario li distruggerà rapidamente. Tuttavia, negli individui immunocompromessi o nei feti privi di un sistema immunitario sviluppato, i tachizoiti possono dilagare e causare danni neurologici significativi.
La sopravvivenza del parassita dipende da un equilibrio tra la sopravvivenza dell'ospite e la proliferazione del parassita. T. gondii raggiunge questo equilibrio manipolando la risposta immunitaria dell'ospite, riducendo la risposta immunitaria dell'ospite e migliorando il vantaggio riproduttivo del parassita. Una volta che infetta una normale cellula ospite, resiste ai danni causati dal sistema immunitario dell'ospite e modifica i processi immunitari dell'ospite. Mentre si fa strada nella cellula ospite, il parassita forma una membrana di vacuolo parassitoforo (PV) dalla membrana della cellula ospite. Il PV incapsula il parassita ed è resistente all'attività del sistema endolisosomiale e può assumere il controllo dei mitocondri e del reticolo endoplasmatico dell'ospite .
Quando invade per la prima volta la cellula, il parassita rilascia proteine ROP dal bulbo dell'organello rhoptry . Queste proteine si traslocano nel nucleo e sulla superficie della membrana PV dove possono attivare le vie STAT per modulare l'espressione delle citochine a livello trascrizionale, legare e inattivare la membrana PV distruggendo le proteine IRG , tra gli altri possibili effetti. Inoltre, alcuni ceppi di T. gondii possono secernere una proteina nota come GRA15, attivando la via NF-κB , che sovraregola la citochina pro-infiammatoria IL-12 nella risposta immunitaria precoce, probabilmente portando alla fase latente del parassita. La capacità del parassita di secernere queste proteine dipende dal suo genotipo e influisce sulla sua virulenza.
Il parassita influenza anche un meccanismo anti-apoptotico, consentendo alle cellule ospiti infette di persistere e replicarsi. Un metodo di resistenza all'apoptosi consiste nell'interrompere le proteine effettrici pro-apoptosi, come BAX e BAK . Per interrompere queste proteine, T. gondii provoca cambiamenti conformazionali alle proteine, che impediscono alle proteine di essere trasportate in vari compartimenti cellulari dove avviano eventi di apoptosi. T. gondii , tuttavia, non causa una sottoregolazione delle proteine effettrici pro-apoptosi.
T. gondii ha anche la capacità di avviare l'autofagia delle cellule dell'ospite. Ciò porta a una diminuzione delle cellule sane e non infette e, di conseguenza, a un minor numero di cellule ospiti che attaccano le cellule infette. La ricerca di Wang et al. rileva che le cellule infette portano a livelli più elevati di autofagosomi nelle cellule normali e infette. La loro ricerca rivela che T. gondii provoca l'autofagia della cellula ospite utilizzando un percorso dipendente dal calcio. Un altro studio suggerisce che il parassita può influenzare direttamente il rilascio del calcio dalle riserve di calcio, che sono importanti per i processi di segnalazione delle cellule.
I meccanismi di cui sopra consentono a T. gondii di persistere in un ospite. Alcuni fattori limitanti per il toxoplasma sono che la sua influenza sulle cellule ospiti è più forte in un sistema immunitario debole ed è dipendente dalla quantità, quindi un gran numero di T. gondii per cellula ospite causa un effetto più grave. L'effetto sull'ospite dipende anche dalla forza del sistema immunitario dell'ospite. Gli individui immunocompetenti normalmente non mostrano sintomi gravi o nessuno, mentre la fatalità o gravi complicazioni possono portare a individui immunocompromessi.
È stato dimostrato che T. gondii produce una proteina chiamata GRA28, rilasciata dal percorso secretorio MYR1, che interferisce con l'espressione genica nelle cellule infette e si traduce in cellule che si comportano come cellule dendritiche, diventando altamente mobili nel corpo.
Poiché il parassita può modificare la risposta immunitaria dell'ospite, può anche avere un effetto, positivo o negativo, sulla risposta immunitaria ad altre minacce patogene. Ciò include, ma non è limitato a, le risposte alle infezioni da Helicobacter felis , Leishmania major o altri parassiti, come Nippostrongylus brasiliensis .
Trasmissione
La toxoplasmosi viene generalmente trasmessa attraverso la bocca quando le oocisti di Toxoplasma gondii o le cisti tissutali vengono mangiate accidentalmente. Può anche verificarsi una trasmissione congenita dalla madre al feto. La trasmissione può avvenire anche durante il processo di trapianto di organi solidi o trapianti di cellule staminali ematogene.
La trasmissione orale può avvenire attraverso:
- Ingestione di carne cruda o parzialmente cotta, in particolare carne di maiale, agnello o cervo contenente cisti di Toxoplasma : la prevalenza dell'infezione nei paesi in cui si consuma tradizionalmente carne poco cotta è stata correlata a questo metodo di trasmissione. Le cisti tissutali possono anche essere ingerite durante il contatto mano-bocca dopo aver maneggiato carne poco cotta o utilizzando coltelli, utensili o taglieri contaminati da carne cruda.
- Ingestione di frutta o verdura non lavate che sono state a contatto con terreno contaminato contenente feci di gatto infette.
- Ingestione di feci di gatto contenenti oocisti: ciò può avvenire attraverso il contatto mano a bocca dopo il giardinaggio, la pulizia della lettiera di un gatto , il contatto con le sabbiere dei bambini; il parassita può sopravvivere nell'ambiente per mesi.
- Ingestione di acqua non trattata e non filtrata attraverso il consumo diretto o l'utilizzo di acqua per la preparazione dei cibi.
- Ingestione di latte crudo e prodotti lattiero-caseari, in particolare latte di capra.
- Ingestione di frutti di mare crudi.
I gatti espellono l'agente patogeno nelle loro feci per un certo numero di settimane dopo aver contratto la malattia, generalmente mangiando un ospite intermedio infetto che potrebbe includere mammiferi (come roditori) o uccelli. Lo spargimento di oocisti di solito inizia dal terzo giorno dopo l'ingestione di ospiti intermedi infetti e può continuare per settimane. Le oocisti non sono infettive quando vengono escrete. Dopo circa un giorno, l'oocisti subisce un processo chiamato sporulazione e diventa potenzialmente patogeno. Oltre ai gatti, anche uccelli e mammiferi, compresi gli esseri umani, sono ospiti intermedi del parassita e sono coinvolti nel processo di trasmissione. Tuttavia la patogenicità varia con l'età e le specie coinvolte nell'infezione e con la modalità di trasmissione di T. gondii .
La toxoplasmosi può essere trasmessa anche attraverso trapianti di organi solidi. I destinatari sieronegativi per il toxoplasma che ricevono organi da donatori sieropositivi per il toxoplasma recentemente infetti sono a rischio. I riceventi di organi con toxoplasmosi latente sono a rischio di riattivazione della malattia nel loro sistema a causa dell'immunosoppressione che si verifica durante il trapianto di organi solidi. I destinatari di trapianti di cellule staminali ematogene possono presentare un rischio maggiore di infezione a causa di periodi più lunghi di immunosoppressione.
I trapianti di cuore e polmone comportano il rischio più elevato di infezione da toxoplasmosi a causa del muscolo striato che costituisce il cuore, che può contenere cisti, e i rischi per altri organi e tessuti variano notevolmente. Il rischio di trasmissione può essere ridotto esaminando donatori e riceventi prima della procedura di trapianto e fornendo il trattamento.
Precauzioni in gravidanza
La toxoplasmosi congenita è una forma specifica di toxoplasmosi in cui un feto viene infettato attraverso la placenta . La toxoplasmosi congenita è associata a morte fetale e aborto spontaneo e, nei neonati, è associata a idrocefalo, calcificazioni cerebrali e corioretinite , che porta a encefalopatia e possibilmente cecità. Se una donna riceve la sua prima esposizione a T. gondii durante la gravidanza, il feto è particolarmente a rischio. Un semplice prelievo di sangue alla prima visita medica prenatale può determinare se una donna ha avuto o meno una precedente esposizione e quindi se è o meno a rischio. Un titolo anticorpale positivo indica una precedente esposizione e immunità e garantisce in gran parte la sicurezza del feto.
Non esistono molte prove sull'effetto dell'educazione prima della gravidanza per prevenire la toxoplasmosi congenita. Tuttavia, è stato suggerito che educare i genitori prima della nascita del bambino sia efficace perché può migliorare l'igiene alimentare, personale e degli animali domestici. Sono necessarie ulteriori ricerche per scoprire se l'educazione prenatale può ridurre la toxoplasmosi congenita.
Per le donne in gravidanza con titoli anticorpali negativi, che indicano nessuna precedente esposizione a T. gondii , è consigliabile eseguire test sierologici con cadenza mensile poiché il trattamento durante la gravidanza per quelle donne esposte a T. gondii per la prima volta riduce drasticamente il rischio di trasmettere il parassita a il feto. Poiché il sistema immunitario di un bambino non si sviluppa completamente per il primo anno di vita e le cisti resistenti che si formano in tutto il corpo sono molto difficili da sradicare con antiprotozoi, un'infezione può essere molto grave nei giovani.
Nonostante questi rischi, le donne incinte non vengono regolarmente sottoposte a screening per la toxoplasmosi nella maggior parte dei paesi, per motivi di rapporto costo-efficacia e per l'elevato numero di falsi positivi generati; Portogallo , Francia , Austria , Uruguay e Italia sono notevoli eccezioni e alcuni programmi di screening regionali operano in Germania , Svizzera e Belgio . Poiché i test prenatali invasivi comportano un certo rischio per il feto (18,5 perdite di gravidanza per caso di toxoplasmosi prevenute), è preferibile lo screening postnatale o neonatale . Le eccezioni sono i casi in cui si notano anomalie fetali e quindi lo screening può essere mirato.
Le donne incinte dovrebbero evitare di maneggiare carne cruda , bere latte crudo (soprattutto latte di capra) ed essere avvisate di non mangiare carne cruda o poco cotta indipendentemente dal tipo. A causa dell'ovvia relazione tra Toxoplasma e gatti, spesso si consiglia anche di evitare l'esposizione alle feci di gatto e di astenersi dal giardinaggio (le feci di gatto sono comuni nel terreno del giardino) o almeno di indossare guanti quando si è così impegnati. La maggior parte dei gatti non emette attivamente oocisti , poiché si infettano nei primi sei mesi di vita, quando rilasciano oocisti per un breve periodo di tempo (1-2 settimane). Tuttavia, queste oocisti vengono seppellite nel terreno, sporulano e rimangono infettivi per periodi che vanno da diversi mesi a più di un anno. Numerosi studi hanno dimostrato che vivere in una famiglia con un gatto non è un fattore di rischio significativo per l'infezione da T. gondii , sebbene vivere con diversi gattini abbia un certo significato.
Nel 2006, un gruppo di ricerca ceco ha scoperto che le donne con alti livelli di anticorpi contro la toxoplasmosi avevano una probabilità significativamente maggiore di dare alla luce maschi rispetto alle femmine. Nella maggior parte delle popolazioni, il tasso di natalità è di circa il 51% di maschi, ma le persone infette da T. gondii avevano una probabilità fino al 72% di avere un maschio.
Diagnosi
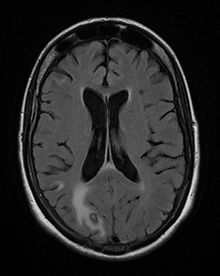
La diagnosi di toxoplasmosi nell'uomo viene effettuata con metodi biologici, sierologici, istologici o molecolari, o con una combinazione dei suddetti. La toxoplasmosi può essere difficile da distinguere dal linfoma primario del sistema nervoso centrale . Imita molte altre malattie infettive, quindi i segni clinici non sono specifici e non sono sufficientemente caratteristici per una diagnosi definitiva. Di conseguenza, la possibilità di una diagnosi alternativa è supportata da un tentativo fallito di terapia antimicrobica ( pirimetamina , sulfadiazina e acido folinico ( USAN : leucovorin)), cioè se i farmaci non producono alcun effetto clinico e nessun miglioramento sulla ripetizione dell'imaging.
T. gondii può anche essere rilevato nel sangue , nel liquido amniotico o nel liquido cerebrospinale utilizzando la reazione a catena della polimerasi . T. gondii può esistere in un ospite come una cisti inattiva che probabilmente eluderebbe il rilevamento.
I test sierologici possono rilevare gli anticorpi T. gondii nel siero del sangue, utilizzando metodi che includono il test del colorante Sabin-Feldman (DT), il test di emoagglutinazione indiretta , il test di anticorpi fluorescenti indiretti (IFA) , il test di agglutinazione diretta , il test di agglutinazione al lattice (LAT ), il saggio di immunoassorbimento legato all'enzima (ELISA) e il test di agglutinazione immunoassorbente (IAAT).
I test più comunemente usati per misurare gli anticorpi IgG sono il DT, l'ELISA, l'IFA e il test di agglutinazione diretta modificato. Gli anticorpi IgG di solito compaiono entro una settimana o due dall'infezione, raggiungono il picco entro uno o due mesi, quindi diminuiscono a vari ritmi. Gli anticorpi IgG anti -toxoplasma generalmente persistono per tutta la vita e pertanto possono essere presenti nel flusso sanguigno a causa di un'infezione in corso o precedente.
In una certa misura, le infezioni acute da toxoplasmosi possono essere differenziate dalle infezioni croniche utilizzando un test di avidità IgG , che è una variazione dell'ELISA. Nella prima risposta all'infezione, le IgG toxoplasma-specifiche hanno una bassa affinità per l'antigene del toxoplasma; nelle settimane e nei mesi successivi l'affinità delle IgG per l'antigene aumenta. Sulla base del test di avidità delle IgG, se le IgG nell'individuo infetto hanno un'alta affinità, significa che l'infezione è iniziata da tre a cinque mesi prima del test. Ciò è particolarmente utile nelle infezioni congenite, in cui lo stato di gravidanza e l'età gestazionale al momento dell'infezione determinano il trattamento.
A differenza delle IgG, gli anticorpi IgM possono essere utilizzati per rilevare un'infezione acuta ma generalmente non un'infezione cronica. Gli anticorpi IgM compaiono prima dopo l'infezione rispetto agli anticorpi IgG e scompaiono più velocemente degli anticorpi IgG dopo la guarigione. Nella maggior parte dei casi, gli anticorpi IgM specifici per T. gondii possono essere rilevati per la prima volta circa una settimana dopo l'acquisizione dell'infezione primaria e diminuiscono entro uno-sei mesi; Il 25% delle persone infette risulta negativo per IgM specifiche per T. gondii entro sette mesi. Tuttavia, le IgM possono essere rilevabili mesi o anni dopo l'infezione, durante la fase cronica, e sono possibili falsi positivi per l'infezione acuta. I test più comunemente usati per la misurazione degli anticorpi IgM sono IgM-ELISA a doppio sandwich , il test IFA e il test di agglutinazione immunosorbente (IgM-ISAGA). I kit di test commerciali hanno spesso una bassa specificità e i risultati riportati sono spesso interpretati erroneamente.
Nel 2021, venti test IgG anti- Toxoplasma commerciali sono stati valutati in una revisione sistematica , rispetto a un metodo di riferimento accettato. La maggior parte erano test immunoenzimatici, seguiti da test di agglutinazione, test immunocromatografici e un test Western Blot . La sensibilità media dei dosaggi IgG variava dall'89,7% al 100% per titoli standard e dal 13,4% al 99,2% per titoli IgG bassi. Alcuni studi hanno evidenziato la capacità di alcuni metodi, in particolare WB, di rilevare le IgG subito dopo l'infezione primaria. La specificità dei dosaggi IgG era generalmente elevata, variando dal 91,3% al 100%; e superiore al 99% per la maggior parte dei test EIA. Il valore predittivo positivo (VPP) non era un indicatore discriminante tra i metodi, mentre sono state riportate disparità significative (87,5%–100%) tra i valori predittivi negativi (VPN), un parametro chiave che valuta la capacità di escludere definitivamente un'infezione da Toxoplasma in pazienti a rischio di infezioni opportunistiche.
Congenito
Le raccomandazioni per la diagnosi di toxoplasmosi congenita includono: diagnosi prenatale basata sul test del liquido amniotico e sugli esami ecografici ; diagnosi neonatale basata su test molecolari della placenta e del cordone ombelicale e test sierologici comparativi madre-bambino e un esame clinico alla nascita; e la diagnosi della prima infanzia basata su esami neurologici e oftalmologici e un'indagine sierologica durante il primo anno di vita. Durante la gravidanza, si raccomandano test sierologici a intervalli di tre settimane.
Anche se la diagnosi di toxoplasmosi si basa fortemente sul rilevamento sierologico di immunoglobuline specifiche anti- Toxoplasma , i test sierologici hanno dei limiti. Ad esempio, potrebbe non riuscire a rilevare la fase attiva dell'infezione da T. gondii perché le specifiche IgG o IgM anti- Toxoplasma potrebbero non essere prodotte fino a diverse settimane dall'infezione. Di conseguenza, una donna incinta potrebbe risultare negativa durante la fase attiva dell'infezione da T. gondii , portando a una toxoplasmosi congenita non rilevata e quindi non trattata. Inoltre, il test potrebbe non rilevare infezioni da T. gondii in pazienti immunocompromessi perché i titoli di IgG o IgM specifiche anti- Toxoplasma potrebbero non aumentare in questo tipo di pazienti.
Molte tecniche basate sulla PCR sono state sviluppate per diagnosticare la toxoplasmosi utilizzando campioni clinici che includono liquido amniotico, sangue , liquido cerebrospinale e biopsia tissutale . La tecnica basata sulla PCR più sensibile è la PCR nidificata , seguita dall'ibridazione dei prodotti della PCR. Il principale svantaggio di queste tecniche è che richiedono molto tempo e non forniscono dati quantitativi.
La PCR in tempo reale è utile per il rilevamento dei patogeni, l'espressione e la regolazione genica e la discriminazione allelica. Questa tecnica PCR utilizza l'attività nucleasica 5' della Taq DNA polimerasi per scindere una sonda di ibridazione marcata con fluorescenza non estensibile durante la fase di estensione della PCR. Un secondo colorante fluorescente, ad esempio 6-carbossi-tetrametil-rodamina, spegne la fluorescenza della sonda intatta. La scissione della nucleasi della sonda di ibridazione durante la PCR rilascia l'effetto di quenching con conseguente aumento della fluorescenza proporzionale alla quantità di prodotto di PCR, che può essere monitorato da un rivelatore di sequenza.
I linfonodi colpiti da Toxoplasma presentano cambiamenti caratteristici, tra cui centri germinali reattivi scarsamente delimitati , gruppi di cellule B monocitoidi e istiociti epitelioidi sparsi .
La classica triade di toxoplasmosi congenita comprende: corioretinite , idrocefalo e arteriosclerosi intracranica . Altre conseguenze includono sordità neurosensoriale, convulsioni e disabilità intellettiva.
La toxoplasmosi congenita può anche avere un impatto sull'udito di un bambino. Fino al 30% dei neonati presenta un certo grado di ipoacusia neurosensoriale. Anche le capacità comunicative del bambino possono risentirne. Uno studio pubblicato nel 2010 ha esaminato 106 pazienti, tutti sottoposti a trattamento per la toxoplasmosi prima di 2,5 mesi. Di questo gruppo, il 26,4% presentava disturbi del linguaggio.
Trattamento
Il trattamento è raccomandato per le persone con gravi problemi di salute, come le persone con HIV la cui conta dei CD4 è inferiore a 200 cellule/mm 3 . Il trimetoprim/sulfametossazolo è il farmaco di scelta per prevenire la toxoplasmosi, ma non per il trattamento della malattia attiva. Uno studio del 2012 mostra un nuovo modo promettente per trattare la forma attiva e latente di questa malattia utilizzando due chinoloni simili all'endochina .
Acuto
I farmaci prescritti per la toxoplasmosi acuta sono i seguenti:
- Pirimetamina – un farmaco antimalarico
-
Sulfadiazina - un antibiotico usato in combinazione con pirimetamina per trattare la toxoplasmosi
- La terapia di associazione viene solitamente somministrata con supplementi di acido folico per ridurre l'incidenza di trombocitopenia .
- La terapia di combinazione è più utile nel contesto dell'HIV.
- Clindamicina
- Spiramicina - un antibiotico usato più spesso per le donne incinte per prevenire l'infezione dei loro figli.
(altri antibiotici, come la minociclina , hanno visto un certo utilizzo come terapia di salvataggio ).
Se infettato durante la gravidanza, la spiramicina è raccomandata nel primo e all'inizio del secondo trimestre, mentre la pirimetamina/sulfadiazina e il leucovorin sono raccomandati alla fine del secondo e terzo trimestre.
Latente
Nelle persone con toxoplasmosi latente, le cisti sono immuni a questi trattamenti, poiché gli antibiotici non raggiungono i bradizoiti in concentrazione sufficiente.
I farmaci prescritti per la toxoplasmosi latente sono:
- Atovaquone - un antibiotico che è stato usato per uccidere le cisti di Toxoplasma all'interno di pazienti affetti da AIDS
- Clindamicina - un antibiotico che, in combinazione con l'atovaquone , sembrava uccidere in modo ottimale le cisti nei topi
Congenito
Quando a una donna incinta viene diagnosticata la toxoplasmosi acuta, l'amniocentesi può essere utilizzata per determinare se il feto è stato infettato o meno. Quando una donna incinta sviluppa una toxoplasmosi acuta, i tachizoiti hanno circa il 30% di probabilità di entrare nel tessuto placentare e da lì entrare e infettare il feto. Con l'aumentare dell'età gestazionale al momento dell'infezione, aumenta anche la possibilità di infezione fetale.
Se il parassita non ha ancora raggiunto il feto, la spiramicina può aiutare a prevenire la trasmissione placentare. Se il feto è stato infettato, la gestante può essere curata con pirimetamina e sulfadiazina , con acido folinico , dopo il primo trimestre. Vengono trattati dopo il primo trimestre perché la pirimetamina ha un effetto antifolato e la mancanza di acido folico può interferire con la formazione del cervello fetale e causare trombocitopenia . L'infezione nelle fasi gestazionali precedenti è correlata a esiti fetali e neonatali peggiori, in particolare quando l'infezione non viene trattata.
I neonati sottoposti a 12 mesi di trattamento anti-toxoplasmosi postnatale hanno una bassa probabilità di perdita dell'udito neurosensoriale. Per questo gruppo sono state create informazioni sulle pietre miliari del trattamento per i bambini con toxoplasmosi congenita.
Epidemiologia
Le infezioni da T. gondii si verificano in tutto il mondo, sebbene i tassi di infezione differiscano significativamente da paese a paese. Per le donne in età fertile, un sondaggio condotto su 99 studi in 44 paesi ha rilevato che le aree di prevalenza più elevata si trovano in America Latina (circa 50-80%), parti dell'Europa centrale e orientale (circa 20-60%), Medio Oriente ( circa il 30-50%), parti del sud-est asiatico (circa il 20-60%) e parti dell'Africa ( circa il 20-55%).
Negli Stati Uniti, i dati del National Health and Nutrition Examination Survey (NHANES) dal 1999 al 2004 hanno rilevato che il 9,0% delle persone nate negli Stati Uniti di età compresa tra 12 e 49 anni era sieropositivo per gli anticorpi IgG contro T. gondii , in calo rispetto al 14,1% misurato nel NHANES 1988-1994. Nell'indagine 1999-2004, il 7,7% delle donne nate negli Stati Uniti e il 28,1% delle donne nate all'estero di età compresa tra 15 e 44 anni erano sieropositive per T. gondii . Una tendenza alla diminuzione della sieroprevalenza è stata osservata da numerosi studi negli Stati Uniti e in molti paesi europei. Il Toxoplasma gondii è considerato la seconda causa di decessi di origine alimentare e la quarta causa di ricoveri di origine alimentare negli Stati Uniti.
Il protista responsabile della toxoplasmosi è T. gondii . Esistono tre tipi principali di T. gondii responsabili dei modelli di toxoplasmosi in tutto il mondo. Esistono tipi I, II e III. Questi tre tipi di T. gondii hanno effetti diversi su determinati ospiti, principalmente topi e esseri umani a causa della loro variazione nei genotipi.
- Tipo I: virulento nei topi e nell'uomo, visto nelle persone con AIDS .
- Tipo II: non virulento nei topi, virulento negli esseri umani (principalmente Europa e Nord America), osservato nelle persone con AIDS.
- Tipo III: non virulento nei topi, virulento principalmente negli animali ma visto in misura minore anche nell'uomo.
Le attuali tecniche di sierotipizzazione possono solo separare i parassiti di tipo I o III da quelli di tipo II.
Poiché il parassita rappresenta una minaccia particolare per i feti quando viene contratto durante la gravidanza, gran parte dei dati epidemiologici globali riguardanti T. gondii proviene da test di sieropositività nelle donne in età fertile. I test di sieropositività cercano la presenza di anticorpi contro T. gondii nel sangue, quindi mentre la sieropositività garantisce che si è stati esposti al parassita, non garantisce necessariamente che si sia cronicamente infetti.
Storia
Toxoplasma gondii fu descritto per la prima volta nel 1908 da Nicolle e Manceaux in Tunisia, e indipendentemente da Splendore in Brasile. Splendore ha riportato il protozoo in un coniglio, mentre Nicolle e Manceaux lo hanno identificato in un roditore nordafricano, il gundi ( Ctenodactylus gundi ). Nel 1909 Nicolle e Manceaux differenziarono il protozoo dalla Leishmania . Nicolle e Manceaux lo chiamarono poi Toxoplasma gondii per la forma ricurva del suo stadio infettivo (radice greca ' toxon ' = arco).
Il primo caso registrato di toxoplasmosi congenita risale al 1923, ma non fu identificato come causato da T. gondii . Janků (1923) descrisse in dettaglio i risultati dell'autopsia di un bambino di 11 mesi che si era presentato in ospedale con idrocefalo . Il ragazzo presentava i classici segni di toxoplasmosi, inclusa la corioretinite (infiammazione della coroide e della retina dell'occhio). L'istologia ha rivelato un certo numero di "sporociti", sebbene Janků non li abbia identificati come T. gondii .
Fu solo nel 1937 che ebbe luogo la prima analisi scientifica dettagliata di T. gondii utilizzando tecniche precedentemente sviluppate per l'analisi dei virus. Nel 1937 Sabin e Olitsky analizzarono T. gondii in scimmie e topi da laboratorio. Sabin e Olitsky hanno dimostrato che T. gondii era un parassita intracellulare obbligato e che anche i topi nutriti con tessuto contaminato da T. gondii hanno contratto l'infezione. Così Sabin e Olitsky hanno dimostrato che T. gondii è un agente patogeno trasmissibile tra animali.
T. gondii è stato descritto per la prima volta come patogeno umano nel 1939 al Babies Hospital di New York City . Wolf, Cowen e Paige hanno identificato l'infezione da T. gondii in una neonata partorita a termine con taglio cesareo . Il bambino ha sviluppato convulsioni e ha avuto corioretinite in entrambi gli occhi a tre giorni. Il bambino ha poi sviluppato l'encefalomielite ed è morto a un mese di età. Wolf, Cowen e Paige hanno isolato T. gondii dalle lesioni del tessuto cerebrale. L'iniezione intracranica di campioni di cervello e midollo spinale in topi, conigli e ratti ha prodotto encefalite negli animali. Wolf, Cowen e Page hanno esaminato altri casi e hanno concluso che T. gondii produceva sintomi riconoscibili e poteva essere trasmesso da madre a figlio.
Il primo caso adulto di toxoplasmosi è stato segnalato nel 1940 senza segni neurologici. Pinkerton e Weinman hanno segnalato la presenza di Toxoplasma in un uomo di 22 anni del Perù, morto per una successiva infezione batterica e febbre.
Nel 1948 Sabin e Feldman crearono un test sierologico basato sulla capacità degli anticorpi del paziente di alterare la colorazione del toxoplasma . Il Sabin Feldman Dye Test è ora il gold standard per identificare l'infezione da Toxoplasma .
La trasmissione del Toxoplasma attraverso il consumo di carne cruda o poco cotta è stata dimostrata da Desmonts et al. nel 1965 a Parigi. Desmonts ha osservato che il consumo terapeutico di carne cruda di manzo o di cavallo in un ospedale per la tubercolosi era associato a un aumento annuo del 50% degli anticorpi contro il toxoplasma . Ciò significa che più T. gondii veniva trasmesso attraverso la carne cruda.
Nel 1974, Desmonts e Couvreur hanno dimostrato che l'infezione durante i primi due trimestri produce la maggior parte dei danni al feto, che la trasmissione dipendeva da quando le madri erano state infettate durante la gravidanza, che le madri con anticorpi prima della gravidanza non trasmettevano l'infezione al feto e che la spiramicina abbassato la trasmissione al feto.
Il toxoplasma ha guadagnato maggiore attenzione negli anni '70 con l'aumento del trattamento immunosoppressore somministrato dopo trapianti di organi o midollo osseo e l' epidemia di AIDS degli anni '80. I pazienti con una ridotta funzionalità del sistema immunitario sono molto più suscettibili alle malattie.
Società e cultura
"La gattara pazza"
"Sindrome della gattara pazza" è un termine coniato dalle testate giornalistiche per descrivere le scoperte scientifiche che collegano il parassita Toxoplasma gondii a diversi disturbi mentali e problemi comportamentali. La sospetta correlazione tra la proprietà del gatto durante l'infanzia e il successivo sviluppo della schizofrenia ha suggerito che erano necessari ulteriori studi per determinare un fattore di rischio per i bambini; tuttavia, studi successivi hanno dimostrato che T. gondii non era un fattore causale nelle psicosi successive. I ricercatori hanno anche scoperto che il possesso di un gatto non aumenta notevolmente il rischio di infezione da T. gondii nelle donne in gravidanza.
Il termine sindrome della gattara pazza attinge sia allo stereotipo che al riferimento culturale popolare. È stato originato quando i casi delle suddette afflizioni sono stati notati tra la popolazione. Una gattara è uno stereotipo culturale di una donna che accumula compulsivamente e stravede per i gatti. Il biologo Jaroslav Flegr è un sostenitore della teoria secondo cui la toxoplasmosi influisce sul comportamento umano.
Casi notevoli
- Il tennista Arthur Ashe sviluppò problemi neurologici a causa della toxoplasmosi (e in seguito fu scoperto che era sieropositivo ).
- L'attore Merritt Butrick era sieropositivo ed è morto di toxoplasmosi a causa del suo sistema immunitario già indebolito.
- A Pedro Zamora , personaggio televisivo di realtà e attivista per l'HIV / AIDS, è stata diagnosticata la toxoplasmosi a causa dell'indebolimento del suo sistema immunitario a causa dell'HIV.
- Il principe François, conte di Clermont , pretendente al trono di Francia aveva la toxoplasmosi congenita; la sua disabilità lo ha fatto trascurare nella linea di successione.
- L'attrice Leslie Ash ha contratto la toxoplasmosi nel secondo mese di gravidanza.
- Il mezzofondista britannico Sebastian Coe ha contratto la toxoplasmosi nel 1983, probabilmente trasmessa da un gatto mentre si allenava in Italia.
- La tennista Martina Navratilova ha avuto la toxoplasmosi durante gli US Open del 1982 .
Altri animali

Sebbene T. gondii abbia la capacità di infettare praticamente tutti gli animali a sangue caldo, la suscettibilità e i tassi di infezione variano ampiamente tra i diversi generi e specie . I tassi di infezione nelle popolazioni della stessa specie possono anche variare ampiamente a causa delle differenze di posizione, dieta e altri fattori.
Sebbene l'infezione da T. gondii sia stata osservata in diverse specie di primati asiatici, la sieroprevalenza degli anticorpi contro T. gondii è stata trovata per la prima volta nei toque macachi ( Macaca sinica ) che sono endemici dell'isola dello Sri Lanka.
I marsupiali australiani sono particolarmente sensibili alla toxoplasmosi. Wallabies , koala , wombat , pademelon e piccoli dasyuridi possono essere uccisi da esso, con i bandicoot barrati orientali che tipicamente muoiono entro circa 3 settimane dall'infezione.
Si stima che il 23% dei suini selvatici in tutto il mondo sia sieropositivo per T. gondii . La sieroprevalenza varia in tutto il mondo con la più alta sieroprevalenza in Nord America (32%) ed Europa (26%) e la più bassa in Asia (13%) e Sud America (5%). Le regioni geografiche situate a latitudini più elevate e le regioni che sperimentano climi più caldi e umidi sono associate a una maggiore sieroprevalenza di T. gondii tra i cinghiali. I cinghiali infetti da T. gondii rappresentano un potenziale rischio per la salute degli esseri umani che consumano la loro carne.
Bestiame
Tra il bestiame , suini, pecore e capre hanno i più alti tassi di infezione cronica da T. gondii . La prevalenza di T. gondii negli animali da carne varia ampiamente sia all'interno che tra i paesi, ed è stato dimostrato che i tassi di infezione sono notevolmente influenzati dalle diverse pratiche di allevamento e gestione. Ad esempio, gli animali tenuti all'aperto o in ambienti liberi sono più a rischio di infezione rispetto agli animali allevati al chiuso o in operazioni di confinamento commerciale .
Maiali
In tutto il mondo, la percentuale di suini che ospitano parassiti vitali è stata misurata tra il 3 e il 71,43% e negli Stati Uniti (tramite test biologico su topi o gatti) fino al 92,7% e fino allo 0%, a seconda dell'allevamento o gregge. Le indagini sulla sieroprevalenza ( anticorpi T. gondii nel sangue) sono più comuni e tali misurazioni sono indicative dell'elevata sieroprevalenza relativa nei suini di tutto il mondo. È stato riscontrato che i suinetti neonati sperimentano l'intera gamma di gravità, inclusa la progressione verso la natimortalità . Ciò è stato particolarmente dimostrato nel fondamentale Thiptara et al. 2006, riportando una cucciolata di tre nati morti e sei vivono in Thailandia. Questa osservazione è stata rilevante non solo per quel paese, ma anche per il controllo della toxoplasmosi nella suinicoltura in tutto il mondo.
Pecora
Insieme ai suini, gli ovini e i caprini sono tra gli animali più comunemente infetti di rilevanza epidemiologica per l'infezione umana. La prevalenza di T. gondii vitale nel tessuto ovino è stata misurata (tramite saggio biologico) fino al 78% negli Stati Uniti e un'indagine del 2011 sulle capre destinate al consumo negli Stati Uniti ha rilevato una sieroprevalenza del 53,4%.
Polli
A causa della mancanza di esposizione all'esterno, i polli allevati in operazioni di confinamento indoor su larga scala non sono comunemente infettati da T. gondii . I polli ruspanti o allevati in cortile sono molto più comunemente infetti. Un'indagine sui polli ruspanti negli Stati Uniti ha rilevato che la sua prevalenza è del 17-100%, a seconda dell'allevamento. Poiché la carne di pollo viene generalmente cotta accuratamente prima del consumo, il pollame non è generalmente considerato un fattore di rischio significativo per l'infezione umana da T. gondii .
Bestiame
Sebbene bovini e bufali possano essere infettati da T. gondii , il parassita viene generalmente eliminato o ridotto a livelli non rilevabili entro poche settimane dall'esposizione. Le cisti tissutali sono raramente presenti nella carne di bufalo o nel manzo e la carne di questi animali è considerata a basso rischio per ospitare parassiti vitali.
Cavalli
I cavalli sono considerati resistenti all'infezione cronica da T. gondii . Tuttavia, cellule vitali sono state isolate da cavalli statunitensi macellati per l'esportazione e una grave toxoplasmosi umana in Francia è stata epidemiologicamente collegata al consumo di carne di cavallo .
Gatti domestici
Nel 1942 fu diagnosticato e segnalato il primo caso di toxoplasmosi felina in un gatto domestico a Middletown, New York. I ricercatori hanno isolato le oocisti dalle feci feline e hanno scoperto che le oocisti potevano essere contagiose fino a 12 mesi nell'ambiente.
La sieroprevalenza di T. gondii nei gatti domestici , in tutto il mondo, è stata stimata intorno al 30-40% e mostra una significativa variazione geografica. Negli Stati Uniti non è stata effettuata alcuna stima nazionale ufficiale, ma le indagini locali hanno mostrato livelli variabili tra il 16% e l'80%. Un'indagine del 2012 su 445 gatti domestici di razza pura e 45 gatti da rifugio in Finlandia ha rilevato una sieroprevalenza complessiva del 48,4%, mentre un'indagine del 2010 sui gatti selvatici di Giza, in Egitto, ha rilevato un tasso di sieroprevalenza del 97,4%. Un altro sondaggio dalla Colombia ha registrato una sieroprevalenza dell'89,3%, mentre uno studio cinese ( Guangdong ) ha rilevato solo una prevalenza del 2,1%.
I tassi di infezione da T. gondii nei gatti domestici variano ampiamente a seconda della dieta e dello stile di vita dei gatti. I gatti selvatici che cacciano per il loro cibo hanno maggiori probabilità di essere infettati rispetto ai gatti domestici, e naturalmente dipende anche dalla prevalenza di prede infette da T. gondii come uccelli e piccoli mammiferi .
La maggior parte dei gatti infetti eliminerà oocisti solo una volta nella vita, per un periodo di circa una o due settimane. Questo spargimento può rilasciare milioni di oocisti, ciascuno in grado di diffondersi e sopravvivere per mesi. Si stima che circa l'1% dei gatti in un dato momento elimini attivamente oocisti.
È difficile controllare la popolazione felina con le oocisti infette a causa della mancanza di un vaccino efficace. Questa rimane una sfida nella maggior parte dei casi ei programmi che sono prontamente disponibili sono di dubbia efficacia.
Roditori
È stato dimostrato che l'infezione da T. gondii altera il comportamento di topi e ratti in modi che si ritiene aumentino le possibilità dei roditori di essere predati dai gatti. I roditori infetti mostrano una riduzione della loro innata avversione per gli odori dei gatti; mentre topi e ratti non infetti generalmente eviteranno le aree contrassegnate dall'urina di gatto o dall'odore del corpo del gatto, questa evitamento è ridotta o eliminata negli animali infetti. Inoltre, alcune prove suggeriscono che questa perdita di avversione potrebbe essere specifica per gli odori felini: quando viene data una scelta tra due odori predatori (gatto o visone ), i roditori infetti mostrano una preferenza significativamente più forte per gli odori di gatto rispetto ai controlli non infetti .
Nei roditori, i cambiamenti comportamentali indotti da T. gondii si verificano attraverso il rimodellamento epigenetico nei neuroni associati ai comportamenti osservati; per esempio, modifica la metilazione epigenetica per indurre l'ipometilazione dei geni correlati all'arginina vasopressina nell'amigdala mediale per ridurre notevolmente l'avversione ai predatori. Simili cambiamenti comportamentali indotti epigeneticamente sono stati osservati anche nei modelli murini di dipendenza, in cui i cambiamenti nell'espressione degli enzimi modificanti l'istone tramite knockout genico o inibizione enzimatica in neuroni specifici hanno prodotto alterazioni nei comportamenti correlati alla droga. La diffusa acetilazione istone-lisina negli astrociti corticali sembra essere un altro meccanismo epigenetico impiegato da T. gondii .
I roditori infetti da T. gondii mostrano una serie di cambiamenti comportamentali oltre alle risposte alterate agli odori dei gatti. I ratti infettati dal parassita mostrano un aumento dei livelli di attività e un comportamento neofobico ridotto . Allo stesso modo, i topi infetti mostrano alterazioni nei modelli di locomozione e comportamento esplorativo durante i test sperimentali. Questi schemi includono percorrere distanze maggiori, muoversi a velocità più elevate, accelerare per periodi di tempo più lunghi e mostrare un tempo di pausa ridotto quando ci si trova in nuove arene. È stato anche dimostrato che i roditori infetti hanno un'ansia inferiore , utilizzando modelli tradizionali come labirinti elevati , arene in campo aperto e test di interazione sociale.
mammiferi marini
Uno studio dell'Università della California, Davis, sulle lontre marine morte , raccolto dal 1998 al 2004, ha rilevato che la toxoplasmosi era la causa della morte per il 13% degli animali. La vicinanza ai deflussi di acqua dolce nell'oceano era un importante fattore di rischio. L'ingestione di oocisti dalle feci di gatto è considerata la fonte ultima più probabile. Il deflusso superficiale contenente feci di gatti selvatici e rifiuti di gatti domestici scaricati nei bagni sono possibili fonti di oocisti. Queste stesse fonti potrebbero anche aver introdotto l'infezione da toxoplasmosi alla foca monaca hawaiana in via di estinzione . L'infezione con il parassita ha contribuito alla morte di almeno quattro foche monache hawaiane. L'infezione di una foca monaca hawaiana con T. gondii è stata notata per la prima volta nel 2004. La diffusione del parassita minaccia il recupero di questo pinnipede altamente minacciato. I parassiti sono stati trovati nei delfini e nelle balene. I ricercatori Black e Massie ritengono che le acciughe, che viaggiano dagli estuari verso l'oceano aperto, possano aiutare a diffondere la malattia.
Panda gigante
Il Toxoplasma gondii è stato segnalato come la causa della morte di un panda gigante tenuto in uno zoo in Cina, morto nel 2014 per gastroenterite acuta e malattie respiratorie . Sebbene apparentemente aneddotico , questo rapporto sottolinea che è probabile che tutte le specie a sangue caldo siano infettate da T. gondii , comprese le specie in via di estinzione come il panda gigante.
Ricerca
L'infezione cronica da T. gondii è stata tradizionalmente considerata asintomatica nelle persone con una normale funzione immunitaria. Alcune evidenze suggeriscono che l'infezione latente può influenzare sottilmente una serie di comportamenti e tendenze umane e l'infezione può alterare la suscettibilità o l'intensità di una serie di disturbi psichiatrici o neurologici.
Nella maggior parte degli studi attuali in cui sono state trovate correlazioni positive tra i titoli anticorpali di T. gondii e alcuni tratti comportamentali o disturbi neurologici, i test di sieropositività per T. gondii vengono condotti dopo l'insorgenza della malattia o del tratto comportamentale in esame; cioè, spesso non è chiaro se l'infezione con il parassita aumenti le possibilità di avere un certo tratto o disturbo, o se avere un certo tratto o disturbo aumenti le possibilità di essere infettati dal parassita. Gruppi di individui con determinati tratti comportamentali o disturbi neurologici possono condividere determinate tendenze comportamentali che aumentano la probabilità di esposizione e infezione da T. gondii ; di conseguenza, è difficile confermare relazioni causali tra infezioni da T. gondii e disturbi neurologici associati o tratti comportamentali.
Salute mentale
Alcune prove collegano T. gondii alla schizofrenia . Due meta-analisi del 2012 hanno rilevato che i tassi di anticorpi contro T. gondii nelle persone con schizofrenia erano 2,7 volte superiori rispetto ai controlli. La positività agli anticorpi contro T. gondii è stata quindi considerata un fattore di rischio intermedio rispetto ad altri fattori di rischio noti. Le precauzioni osservate includono che i test anticorpali non rilevano direttamente la toxoplasmosi, la maggior parte delle persone affette da schizofrenia non ha anticorpi per la toxoplasmosi e potrebbero esistere bias di pubblicazione . Mentre la maggior parte di questi studi ha testato persone già diagnosticate con schizofrenia per gli anticorpi T. gondii , sono state trovate associazioni tra T. gondii e schizofrenia prima dell'insorgenza dei sintomi della schizofrenia. Le differenze di sesso nell'età di insorgenza della schizofrenia possono essere spiegate in parte da un secondo picco di incidenza dell'infezione da T. gondii durante i 25-30 anni solo nelle femmine. Sebbene non sia chiaro un meccanismo a supporto dell'associazione tra schizofrenia e infezione da T. gondii , gli studi hanno studiato una base molecolare di questa correlazione. I farmaci antipsicotici usati nella schizofrenia sembrano inibire la replicazione dei tachizoiti di T. gondii nella coltura cellulare. Supponendo che esista un nesso causale tra T. gondii e la schizofrenia, gli studi devono ancora determinare perché solo alcuni individui con toxoplasmosi latente sviluppano la schizofrenia; alcune spiegazioni plausibili includono una diversa suscettibilità genetica, differenze di ceppo del parassita e differenze nel percorso dell'infezione acquisita da T. gondii .
Sono state inoltre trovate correlazioni tra i titoli anticorpali contro T. gondii e il disturbo ossessivo compulsivo , così come il suicidio tra le persone con disturbi dell'umore, compreso il disturbo bipolare . I titoli anticorpali positivi per T. gondii sembrano non essere correlati con la depressione maggiore o la distimia . Sebbene esista una correlazione tra T. gondii e molti disturbi psicologici, il meccanismo sottostante non è chiaro. Uno studio del 2016 su 236 persone con alti livelli di anticorpi contro la toxoplasmosi ha rilevato che "c'erano poche prove che T. gondii fosse correlato a un aumento del rischio di disturbi psichiatrici, scarso controllo degli impulsi, aberrazioni della personalità o compromissione neurocognitiva".
Disordini neurologici
L'infezione latente è stata collegata al morbo di Parkinson e al morbo di Alzheimer .
Gli individui con sclerosi multipla mostrano tassi di infezione inferiori di circa il 15% rispetto al pubblico in generale.
Incidente stradale
L'infezione latente da T. gondii negli esseri umani è stata associata a un rischio più elevato di incidenti automobilistici , potenzialmente a causa di prestazioni psicomotorie compromesse o di profili di personalità più inclini al rischio.
Cambiamento climatico
È stato segnalato che i cambiamenti climatici influenzano la presenza, la sopravvivenza, la distribuzione e la trasmissione di T. gondii . T. gondii è stato identificato nell'Artico canadese, un luogo che un tempo era troppo freddo per la sua sopravvivenza. Temperature più elevate aumentano il tempo di sopravvivenza di T. gondii . Più scioglimento della neve e precipitazioni possono aumentare la quantità di oocisti di T. gondii che vengono trasportate attraverso il flusso del fiume. I cambiamenti nelle popolazioni di uccelli, roditori e insetti e nei modelli di migrazione possono influire sulla distribuzione di T. gondii a causa del loro ruolo di serbatoio e vettore. Si suggerisce anche che l'urbanizzazione e il degrado ambientale naturale influenzino la trasmissione di T. gondii e aumentino il rischio di infezione.
Guarda anche
Riferimenti
- Parti di questo articolo sono tratte dalla scheda informativa del CDC di dominio pubblico: Toxoplasmosis
Bibliografia
- Weiss, LM; Kim, K. (28 aprile 2011).Toxoplasma gondii : il modello Apicomplexan. Prospettive e metodi . Stampa accademica. ISBN 978-0-08-047501-1. Estratto il 12 marzo 2013 .
- Dubey, Giappone (2016). Toxoplasmosi degli animali e dell'uomo (2a ed.). Boca Raton : Stampa CRC . pp. xvii+313. ISBN 978-1-4200-9237-0. OCLC 423572366 . ISBN 1-4200-9236-7 ISBN 9781420092363
- Dubey JP, Lindsay DS, Speer CA (aprile 1998). "Strutture di Toxoplasma gondii tachizoiti, bradizoiti e sporozoiti e biologia e sviluppo di cisti tissutali" . Recensioni di microbiologia clinica . 11 (2): 267–299. doi : 10.1128/CMR.11.2.267 . PMC 106833 . PMID 9564564 .
- Jaroslav Flegr (2011). Pozor, Toxo! . Accademia, Praga, Repubblica Ceca. ISBN 978-80-200-2022-2.
link esterno
- Come un parassita trasmesso da un gatto infetta l'uomo (National Geographic)
- Toxoplasmosi al manuale Merck di diagnosi e terapia Professional Edition
- Toxoplasmosi presso l'Agenzia per la protezione della salute (HPA), Regno Unito
- Immagini del database di immagini mediche della toxoplasmosi
- Video-intervista con il professor Robert Sapolsky sulla toxoplasmosi e i suoi effetti sul comportamento umano (24:27 min)
- "Toxoplasmosi" . MedlinePlus . Biblioteca Nazionale di Medicina degli Stati Uniti.