Serie Balmer - Balmer series

La serie di Balmer , o righe di Balmer in fisica atomica , è una delle sei serie denominate che descrivono le emissioni delle righe spettrali dell'atomo di idrogeno . La serie di Balmer viene calcolata utilizzando la formula di Balmer, un'equazione empirica scoperta da Johann Balmer nel 1885.
Il visibile spettro della luce da idrogeno mostra quattro lunghezze d'onda , 410 nm , 434 nm, 486 nm e 656 nm, che corrispondono alle emissioni di fotoni da elettroni in stati eccitati transizione al livello quantistico descritto dal numero quantico principale n è uguale a 2. Ci sono diverse importanti linee di Balmer ultraviolette con lunghezze d'onda inferiori a 400 nm. Il numero di queste righe è un continuum infinito poiché si avvicina al limite di 364,5 nm nell'ultravioletto.
Dopo la scoperta di Balmer, sono state scoperte altre cinque serie spettrali dell'idrogeno , corrispondenti a elettroni che passano a valori di n diversi da due .
Panoramica
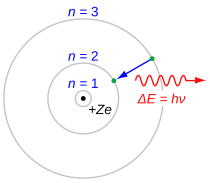
La serie di Balmer è caratterizzata dalla transizione dell'elettrone da n ≥ 3 a n = 2, dove n si riferisce al numero quantico radiale o numero quantico principale dell'elettrone. Le transizioni sono denominate in sequenza dalla lettera greca: n = 3 a n = 2 è chiamato H-α, da 4 a 2 è H-β, da 5 a 2 è H-γ e da 6 a 2 è H-δ. Poiché le prime righe spettrali associate a questa serie si trovano nella parte visibile dello spettro elettromagnetico , queste righe sono storicamente denominate "H-alfa", "H-beta", "H-gamma", e così via, dove H è l'elemento idrogeno.
Transizione di n 3→2 4→2 5→2 6→2 7→2 8→2 9→2 →2 Nome H-α / Ba-α H-β / Ba-β H-γ / Ba-γ H-δ / Ba-δ H-ε / Ba-ε H-ζ / Ba-ζ H-η / Ba-η Pausa balsamo Lunghezza d'onda (nm, aria) 656.279 486.135 434.0472 410.1734 397.0075 388.9064 383.5397 364.6 Differenza energetica (eV) 1.89 2.55 2.86 3.03 3.13 3.19 3.23 3.40 Colore rosso Acqua Blu Viola ( Ultravioletto ) (Ultravioletto) (Ultravioletto) (Ultravioletto)
Sebbene i fisici fossero a conoscenza delle emissioni atomiche prima del 1885, non disponevano di uno strumento per prevedere con precisione dove avrebbero dovuto apparire le righe spettrali. L'equazione di Balmer prevede le quattro righe spettrali visibili dell'idrogeno con elevata precisione. L'equazione di Balmer ha ispirato l' equazione di Rydberg come una sua generalizzazione, e questo a sua volta ha portato i fisici a trovare le serie di Lyman , Paschen e Brackett , che prevedevano altre righe spettrali dell'idrogeno trovate al di fuori dello spettro visibile .
La riga spettrale rossa H-alfa della serie di Balmer dell'idrogeno atomico, che è la transizione dal guscio n = 3 al guscio n = 2, è uno dei colori cospicui dell'universo . Contribuisce con una linea rossa brillante agli spettri della nebulosa di emissione o di ionizzazione, come la Nebulosa di Orione , che sono spesso regioni H II che si trovano nelle regioni di formazione stellare. Nelle immagini a colori reali, queste nebulose hanno un colore rosa-rossastro dovuto alla combinazione delle linee di Balmer visibili emesse dall'idrogeno.
Successivamente, si scoprì che quando le righe della serie di Balmer dello spettro dell'idrogeno furono esaminate ad altissima risoluzione, erano doppietti ravvicinati. Questa suddivisione è chiamata struttura fine . È stato anche scoperto che gli elettroni eccitati da gusci con n maggiore di 6 potrebbero saltare al guscio n = 2, emettendo sfumature di ultravioletto quando lo fanno.

La formula di Balmer
Balmer notò che una singola lunghezza d'onda aveva una relazione con ogni riga dello spettro dell'idrogeno che si trovava nella regione della luce visibile . Quella lunghezza d'onda era364,506 82 nm . Quando un numero intero maggiore di 2 viene quadrato e poi diviso per se stesso al quadrato meno 4, allora quel numero viene moltiplicato per364.506 82 nm (vedi equazione sotto) ha dato la lunghezza d'onda di un'altra riga nello spettro dell'idrogeno. Con questa formula, fu in grado di dimostrare che alcune misurazioni di righe fatte ai suoi tempi mediante spettroscopia erano leggermente imprecise e la sua formula prediceva righe che furono poi trovate anche se non erano ancora state osservate. Anche il suo numero si è rivelato il limite della serie. L'equazione di Balmer potrebbe essere utilizzata per trovare la lunghezza d' onda delle linee di assorbimento/emissione ed è stata originariamente presentata come segue (salvo per un cambiamento di notazione per dare la costante di Balmer come B ):
In cui si
- λ è la lunghezza d'onda.
- B è una costante con il valore di3.645 0682 × 10 −7 m o364,506 82 nm .
- m è uguale a 2
- n è un intero tale che n > m .
Nel 1888 il fisico Johannes Rydberg generalizzò l'equazione di Balmer per tutte le transizioni dell'idrogeno. L'equazione comunemente usata per calcolare la serie di Balmer è un esempio specifico della formula di Rydberg e segue come un semplice riarrangiamento matematico reciproco della formula sopra (usando convenzionalmente una notazione di m per n come singola costante integrale necessaria):
dove λ è la lunghezza d'onda assorbita / luce emessa e R H è la costante di Rydberg per l'idrogeno. Si vede che la costante di Rydberg è uguale a4/B nella formula di Balmer, e questo valore, per un nucleo infinitamente pesante, è 4/3.645 0682 × 10 −7 m = 10 973 731 .57 m -1 .
Ruolo in astronomia
La serie di Balmer è particolarmente utile in astronomia perché le linee di Balmer appaiono in numerosi oggetti stellari a causa dell'abbondanza di idrogeno nell'universo , e quindi sono comunemente viste e relativamente forti rispetto alle linee di altri elementi.
La classificazione spettrale delle stelle, che è principalmente una determinazione della temperatura superficiale, si basa sulla forza relativa delle righe spettrali, e la serie di Balmer in particolare è molto importante. Altre caratteristiche di una stella che possono essere determinate da un'attenta analisi del suo spettro includono la gravità superficiale (relativa alle dimensioni fisiche) e la composizione.
Poiché le linee di Balmer sono comunemente viste negli spettri di vari oggetti, vengono spesso utilizzate per determinare le velocità radiali dovute allo spostamento doppler delle linee di Balmer. Questo ha usi importanti in tutta l'astronomia, dal rilevamento di stelle binarie , esopianeti , oggetti compatti come stelle di neutroni e buchi neri (tramite il movimento dell'idrogeno nei dischi di accrescimento intorno a loro), identificando gruppi di oggetti con movimenti simili e presumibilmente origini ( gruppi in movimento , ammassi stellari , ammassi e detriti da collisioni), determinando distanze (in realtà redshifts ) di galassie o quasar , e individuando oggetti sconosciuti mediante analisi della loro spettro.
Le linee di Balmer possono apparire come linee di assorbimento o di emissione in uno spettro, a seconda della natura dell'oggetto osservato. Nelle stelle , le righe di Balmer si vedono solitamente in assorbimento, e sono "più forti" nelle stelle con una temperatura superficiale di circa 10.000 kelvin ( tipo spettrale A). Negli spettri della maggior parte delle galassie spirali e irregolari, dei nuclei galattici attivi , delle regioni H II e delle nebulose planetarie , le righe di Balmer sono righe di emissione.
Negli spettri stellari, la riga H-epsilon (transizione 7→2, 397.007 nm) è spesso mischiata con un'altra riga di assorbimento causata dal calcio ionizzato noto come "H" (la designazione originale data da Joseph von Fraunhofer ). H-epsilon è separato da 0,16 nm da Ca II H a 396.847 nm e non può essere risolto in spettri a bassa risoluzione. La linea H-zeta (transizione 8→2) è similmente mischiata con una linea dell'elio neutra vista nelle stelle calde.
Guarda anche
- Spettroscopia astronomica
- Modello di Bohr
- Serie spettrale dell'idrogeno
- serie Lyman
- formula di Rydberg
- Classificazione stellare
- Giustificazione teorica e sperimentale per l'equazione di Schrödinger


