Acetato di calcio - Calcium acetate
|
|
 Cristalli di acetato di calcio
|
|
| nomi | |
|---|---|
|
Nome IUPAC preferito
diacetato di calcio |
|
| Altri nomi
Acetato di calce
Etanoato di calcio |
|
| Identificatori | |
|
Modello 3D ( JSmol )
|
|
| Abbreviazioni | Ca(OAc) 2 |
| 3692527 | |
| CheBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Scheda informativa dell'ECHA |
100.000.492 |
| Numero CE | |
| E numero | E263 (conservanti) |
| 22320 | |
| KEGG | |
|
PubChem CID
|
|
| Numero RTECS | |
| UNII | |
|
Cruscotto CompTox ( EPA )
|
|
|
|
|
|
| Proprietà | |
| C 4 H 6 Ca O 4 | |
| Massa molare | 158.166 g·mol −1 |
| Aspetto esteriore | Solido bianco igroscopico |
| Odore | leggero odore di acido acetico |
| Densità | 1.509 g/cm 3 |
| Punto di fusione | 160 °C (320 °F; 433 K) decomposizione in CaCO 3 + acetone |
| 37,4 g/100 mL (0 °C) 34,7 g/100 mL (20 °C) 29,7 g/100 mL (100 °C) |
|
| solubilità | leggermente solubile in metanolo , idrazina insolubile in acetone , etanolo e benzene |
| Acidità (p K a ) | circa. 0,7 |
| -70,7·10 −6 cm 3 /mol | |
|
Indice di rifrazione ( n D )
|
1.55 |
| Farmacologia | |
| V03AE07 ( CHI ) | |
| Pericoli | |
| NFPA 704 (diamante di fuoco) | |
| da 680 a 730 °C (da 1.256 a 1.346 °F; da 953 a 1.003 K) | |
| Dose o concentrazione letale (LD, LC): | |
|
LD 50 ( dose media )
|
4280 mg/kg (orale, ratto) |
| Composti correlati | |
|
Altri cationi
|
Acetato di magnesio |
|
Salvo indicazione contraria, i dati sono forniti per i materiali nel loro stato standard (a 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Riferimenti alla casella informativa | |
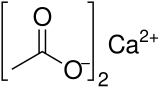
L'acetato di calcio è un composto chimico che è un sale di calcio dell'acido acetico . Ha la formula Ca(C 2 H 3 O 2 ) 2 . Il suo nome standard è acetato di calcio, mentre etanoato di calcio è il nome sistematico. Un nome più antico è acetato di calce . La forma anidra è molto igroscopica ; quindi il monoidrato (Ca(CH 3 COO) 2 •H 2 O) è la forma comune.
Produzione
Acetato di calcio può essere preparato mediante macerazione carbonato di calcio (trovato in gusci d'uovo, o carbonato comune rocce come calcare o marmo ) o calce idrata in aceto :
- CaCO 3 (s) + 2CH 3 COOH (aq) → Ca(CH 3 COO) 2 (aq) + H 2 O(l) + CO 2 (g)
- Ca(OH) 2 (s) + 2CH 3 COOH(aq) → Ca(CH 3 COO) 2 (aq) + 2H 2 O(l)
Poiché entrambi i reagenti sarebbero stati disponibili preistorica, la sostanza chimica sarebbe stata osservabile come cristalli allora.
Usi
- Nella malattia renale , i livelli ematici di fosfato possono aumentare (chiamato iperfosfatemia ) portando a problemi alle ossa. L'acetato di calcio lega il fosfato nella dieta per abbassare i livelli di fosfato nel sangue.
- L'acetato di calcio viene utilizzato come additivo alimentare , come stabilizzante, tampone e sequestrante , principalmente nei prodotti dolciari con il numero E263.
- Il tofu si ottiene tradizionalmente coagulando il latte di soia con solfato di calcio . Si è scoperto che l'acetato di calcio è un'alternativa migliore; essendo solubile, richiede meno abilità e una quantità minore.
- Poiché è poco costoso, l'acetato di calcio era una volta un materiale di partenza comune per la sintesi dell'acetone prima dello sviluppo del processo del cumene :
- Ca(CH 3 COO) 2 → CaCO 3 (s) + (CH 3 ) 2 CO
- Una soluzione satura di acetato di calcio in alcool forma un gel semisolido e infiammabile che è molto simile a prodotti a "calore in scatola" come Sterno . Gli insegnanti di chimica preparano spesso "California Snowballs", una miscela di soluzione di acetato di calcio ed etanolo . Il gel risultante è di colore biancastro e può essere formato per assomigliare a una palla di neve .
Evento naturale
L'acetato di calcio puro è ancora sconosciuto tra i minerali. La calcite - acetato di calcio cloruro pentaidrato - è elencata come un minerale noto, ma la sua genesi è probabilmente antropica e potrebbe presto essere screditata.
Riferimenti
- ^ Unione internazionale di chimica pura e applicata (2014). Nomenclatura della chimica organica: raccomandazioni IUPAC e nomi preferiti 2013 . La Società Reale di Chimica . P. 801. doi : 10.1039/9781849733069 . ISBN 978-0-85404-182-4.
- ^ Dale L. Perry (19 maggio 2011). Manuale di composti inorganici (seconda ed.). Taylor & Francesco. P. 84. ISBN 978-1-4398-1461-1.
- ^ "Acetato di calcio" . Clinica Mayo . Estratto il 19 novembre 2019 .
- ^ JY Lu, Eloise Carter e RA Chung (1980): "Use of Calcium Salts for Soybean Curd Preparation" Journal of Food Science , volume 45, numero 1, pagine 32–34 doi : 10.1111/j.1365-2621.1980.tb03864. X
- ^ Leo Frank Goodwin; Edward Tyghe Sterne (1920). "Perdite subite nella preparazione dell'acetone mediante la distillazione dell'acetato di calce" . Chimica industriale e ingegneristica . 12 (3): 240-243. doi : 10.1021/ie50123a012 .
- ^ EGR Ardagh; dC Barbour; GE McClellan; EW McBride (1924). "Distillazione di acetato di calce". Chimica industriale e ingegneristica . 16 (11): 1133–1139. doi : 10.1021/ie50179a013 .
- ^ "Canned Heat" sul Journal of Chemical Education "La chimica prende vita!"
- ^ Risorse per l'insegnamento della chimica
- ^ "Calcacite" .
- ^ "Elenco dei minerali" . 21 marzo 2011.

