Reazione Suzuki - Suzuki reaction
| Reazione Suzuki | |
|---|---|
| Prende il nome | Akira Suzuki |
| Tipo di reazione | Reazione di accoppiamento |
| Identificatori | |
| Portale di chimica organica | suzuki-accoppiamento |
| ID ontologia RSC | RXNO:0000140 |
La reazione di Suzuki è una reazione organica , classificata come reazione di cross-coupling , in cui i partner di accoppiamento sono un acido boronico e un organoalogenuro e il catalizzatore è un complesso di palladio(0) . È stato pubblicato per la prima volta nel 1979 da Akira Suzuki e ha condiviso il Premio Nobel per la Chimica 2010 con Richard F. Heck e Ei-ichi Negishi per il loro contributo alla scoperta e allo sviluppo di accoppiamenti incrociati catalizzati da palladio nella sintesi organica. Questa reazione è anche nota come reazione Suzuki-Miyaura o semplicemente come accoppiamento Suzuki . È ampiamente usato per sintetizzare poli olefine , stireni , e sostituiti bifenili . Sono state pubblicate diverse recensioni che descrivono i progressi e lo sviluppo della reazione Suzuki. Lo schema generale per la reazione di Suzuki è mostrato sotto, dove un singolo legame carbonio-carbonio è formato accoppiando una specie di organoboro (R 1 -BY 2 ) con un alogenuro (R 2 -X) usando un catalizzatore di palladio e una base .
-
( Eq.1 )
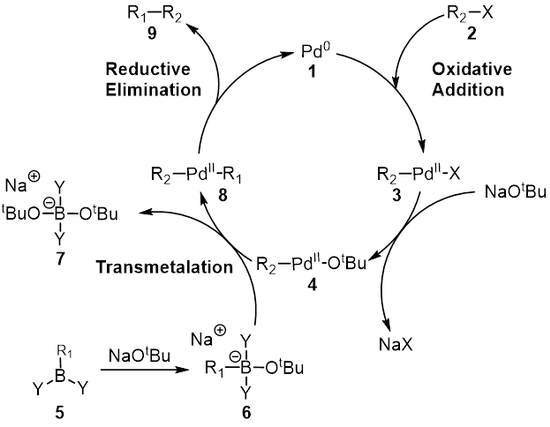
Meccanismo di reazione
Il meccanismo della reazione di Suzuki si vede meglio dal punto di vista del catalizzatore al palladio 1 . Il primo passo è l' aggiunta ossidativa del palladio all'alogenuro 2 per formare la specie organopalladio 3 . La reazione ( metatesi ) con la base dà l' intermedio 4 , che per transmetallazione con il complesso boronato 6 (prodotto dalla reazione dell'acido boronico 5 con la base) forma la specie organopalladio 8 . L'eliminazione riduttiva del prodotto desiderato 9 ripristina l'originale catalizzatore al palladio 1 che completa il ciclo catalitico . L'accoppiamento Suzuki avviene in presenza di una base e per lungo tempo il ruolo della base non è stato compreso appieno. Inizialmente si credeva che la base formasse un trialchilborato (R 3 B-OR), nel caso di una reazione di un trialchilborano (BR 3 ) e un alcossido ( − OR); questa specie potrebbe essere considerata più nucleofila e quindi più reattiva nei confronti del complesso del palladio presente nella fase di transmetallazione. Duc e collaboratori hanno studiato il ruolo della base nel meccanismo di reazione per l'accoppiamento di Suzuki e hanno scoperto che la base ha tre ruoli: formazione del complesso del palladio [ArPd(OR)L 2 ], formazione del trialchilborato e accelerazione di l'eliminazione riduttiva passo per reazione dell'alcossido con il complesso del palladio.
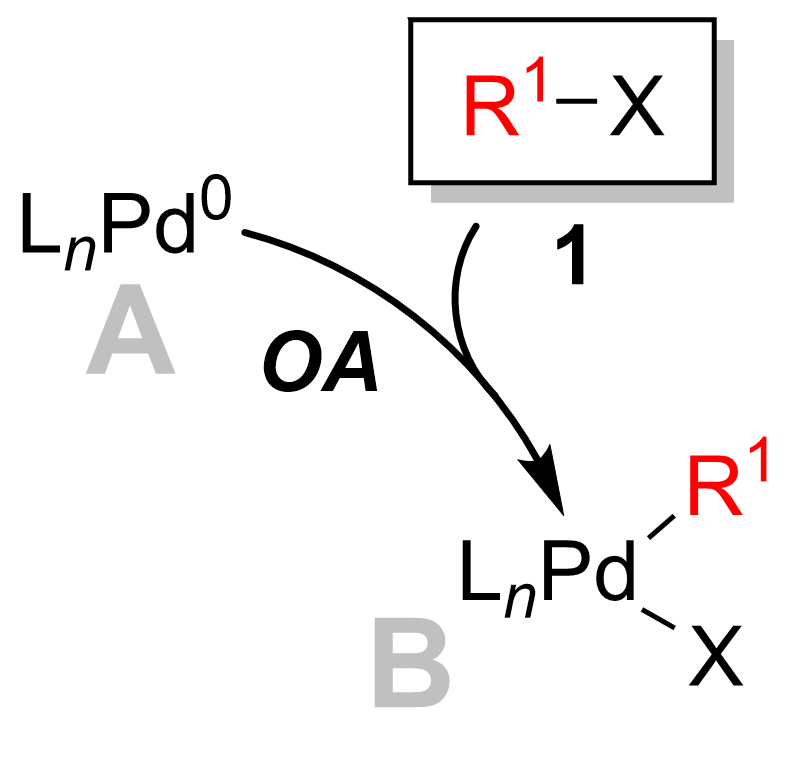
Addizione ossidativa
Nella maggior parte dei casi l'addizione ossidativa è la fase determinante della velocità del ciclo catalitico. Durante questa fase, il catalizzatore di palladio viene ossidato da palladio(0) a palladio(II). Il catalizzatore di palladio 1 è accoppiato con l'alogenuro alchilico 2 per fornire un complesso 3 di organopalladio . Come si vede nel diagramma sottostante, la fase di addizione ossidativa rompe il legame carbonio - alogeno dove il palladio è ora legato sia all'alogeno che al gruppo R.
L'addizione ossidativa procede con la ritenzione della stereochimica con gli alogenuri vinilici , mentre dà l' inversione della stereochimica con gli alogenuri allilici e benzilici . L'addizione ossidativa inizialmente forma il complesso cis- palladio, che si isomerizza rapidamente al complesso trans.
Il Suzuki Coupling avviene con ritenzione di configurazione sui doppi legami sia per il reagente organoboro che per l'alogenuro. Tuttavia, la configurazione di quel doppio legame, cis o trans è determinata dall'isomerizzazione da cis a trans del complesso di palladio nella fase di addizione ossidativa in cui il complesso di palladio trans è la forma predominante. Quando l'organoboro è attaccato a un doppio legame ed è accoppiato a un alogenuro di alchenile, il prodotto è un diene come mostrato di seguito.
Transmetallazione
La transmetallazione è una reazione organometallica in cui i ligandi vengono trasferiti da una specie all'altra. Nel caso dell'accoppiamento Suzuki i ligandi vengono trasferiti dalla specie organoboro 6 al complesso palladio(II) 4 dove la base aggiunta nel passaggio precedente viene scambiata con il sostituente R 1 sulle specie organoboro per dare il nuovo palladio (II) complesso 8 . L'esatto meccanismo di transmetallazione per l'accoppiamento Suzuki resta da scoprire. I composti di organoboro non subiscono transmetallazione in assenza di base ed è quindi opinione diffusa che il ruolo della base sia quello di attivare il composto di organoboro oltre a facilitare la formazione di R 2 -Pd ll -O t Bu da R 2 - Pd ll- X.
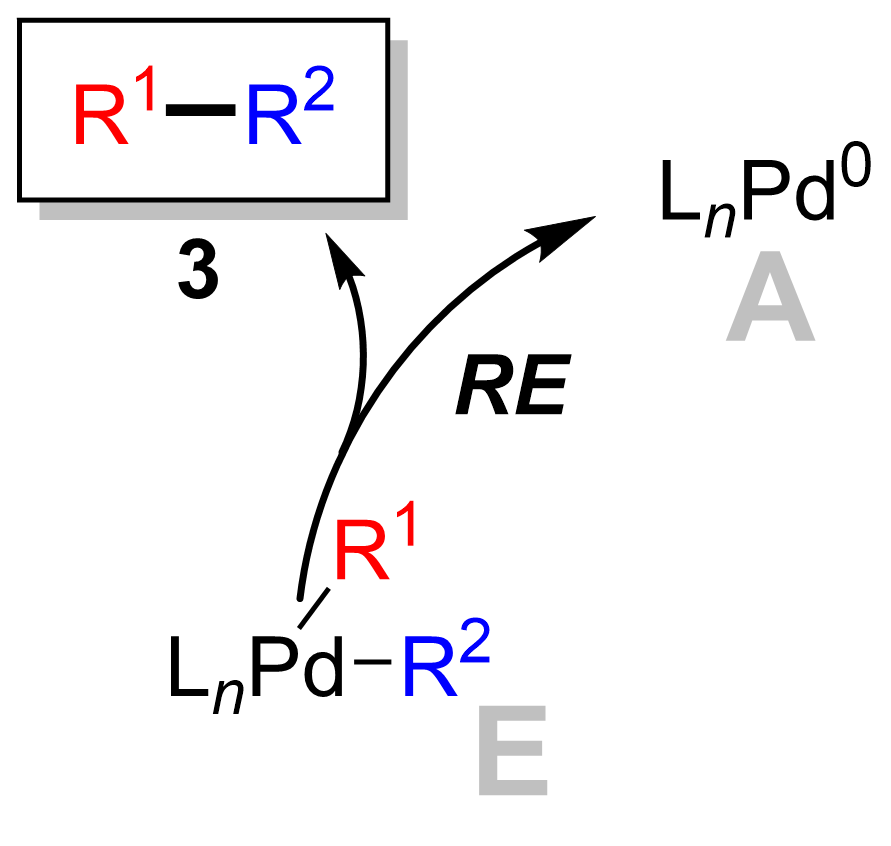
Eliminazione riduttiva
La fase finale è la fase di eliminazione riduttiva in cui il complesso del palladio(II) ( 8 ) elimina il prodotto ( 9 ) e rigenera il catalizzatore del palladio(0)( 1 ). Usando l' etichettatura del deuterio , Ridgway et al. hanno mostrato che l'eliminazione riduttiva procede con la ritenzione della stereochimica.
Il ligando gioca un ruolo importante nella reazione di Suzuki. Tipicamente, il legante della fosfina viene utilizzato nella reazione di Suzuki. Il ligando della fosfina aumenta la densità elettronica al centro del metallo del complesso e quindi aiuta nella fase di addizione ossidativa. Inoltre, l'ingombro di sostituzione del ligando fosfina aiuta nella fase di eliminazione riduttiva. Tuttavia, il legante di carbeni N-eterociclici è stato recentemente utilizzato in questo accoppiamento incrociato, a causa dell'instabilità del legante della fosfina in condizioni di reazione di Suzuki. I carbeni N-eterociclici sono più ricchi di elettroni e più voluminosi del ligando fosfina. Pertanto, entrambi i fattori sterici ed elettronici del ligando carbene N-eterociclico aiutano a stabilizzare il catalizzatore Pd(0) attivo.
Vantaggi
I vantaggi dell'accoppiamento Suzuki rispetto ad altre reazioni simili includono la disponibilità di comuni acidi boronici, condizioni di reazione blande e la sua natura meno tossica. Gli acidi boronici sono meno tossici e più sicuri per l'ambiente rispetto ai composti organostannici e organozinco . È facile rimuovere i sottoprodotti inorganici dalla miscela di reazione. Inoltre, questa reazione è preferibile poiché utilizza reagenti relativamente economici e facilmente preparati. La possibilità di utilizzare l'acqua come solvente rende questa reazione più economica, ecologica e pratica da utilizzare con una varietà di reagenti idrosolubili. Un'ampia varietà di reagenti può essere utilizzato per l'accoppiamento di Suzuki, ad esempio, arile - o vinile acidi -boronic e aril - o vinile -halides. Il lavoro ha anche esteso l'ambito della reazione per incorporare bromuri alchilici. Oltre a molti diversi tipi di alogenuri possibili per la reazione di accoppiamento Suzuki, la reazione funziona anche con pseudoalogenuri come i triflati (OTf), in sostituzione degli alogenuri . La reattività relativa per il partner di accoppiamento con l'alogenuro o pseudoalogenuro è: R 2 –I > R 2 –OTf > R 2 –Br >> R 2 –Cl. Al posto degli acidi boronici possono essere usati esteri boronici e sali organotrifluoroborati . Il catalizzatore può anche essere un catalizzatore a base di nanomateriali di palladio . Con un nuovo ligando organofosfinico ( SPhos ), è stato riportato un caricamento del catalizzatore fino allo 0,001% in moli:. Questi progressi e la flessibilità complessiva del processo hanno reso l'accoppiamento Suzuki ampiamente accettato per la sintesi chimica.
Applicazioni
Applicazioni industriali
La reazione di accoppiamento Suzuki è scalabile ed economica per l'uso nella sintesi di intermedi per prodotti farmaceutici o prodotti della chimica fine . La reazione di Suzuki una volta era limitata da alti livelli di catalizzatore e dalla limitata disponibilità di acidi boronico . Sono stati trovati anche sostituti per gli alogenuri, aumentando il numero di partner di accoppiamento anche per l'alogenuro o lo pseudoalogenuro. Sono state effettuate reazioni in scala nella sintesi di una serie di importanti composti biologici come CI-1034 che ha utilizzato un partner di accoppiamento triflato e acido boronico che è stato eseguito su una scala di 80 chilogrammi con una resa del 95%.
Un altro esempio è l'accoppiamento di 3-piridilborano e 1-bromo-3-(metilsulfonil)benzene che ha formato un intermedio utilizzato nella sintesi di un potenziale agente del sistema nervoso centrale. La reazione di accoppiamento per formare l'intermedio prodotto (278 chilogrammi) con una resa del 92,5%.
Sforzi significativi sono stati profusi nello sviluppo di catalizzatori eterogenei per la reazione Suzuki CC, motivati dai guadagni prestazionali nel processo industriale (eliminando la separazione del catalizzatore dal substrato), e recentemente è stato dimostrato che un catalizzatore eterogeneo a singolo atomo di Pd ha prestazioni superiori al catalizzatore omogeneo Pd(PPh 3 ) 4 predefinito industriale .
Applicazioni sintetiche
L'accoppiamento Suzuki è stato frequentemente utilizzato nella sintesi di composti complessi. L'accoppiamento Suzuki è stato utilizzato su un derivato citronellale per la sintesi del caparratriene , un prodotto naturale altamente attivo contro la leucemia:
Variazioni
catalizzatore metallico
Sono stati sviluppati vari usi catalitici di metalli diversi dal palladio (specialmente nichel). La prima reazione di cross-coupling catalizzata dal nichel è stata riportata da Percec e collaboratori nel 1995 utilizzando aril mesilati e acidi boronici. Anche se per la reazione era necessaria una quantità maggiore di catalizzatore di nichel , circa il 5% in moli, il nichel non è un metallo costoso o prezioso come il palladio . La reazione di accoppiamento Suzuki catalizzata dal nichel ha anche consentito un numero di composti che non funzionavano o funzionavano peggio per il sistema catalizzato al palladio rispetto al sistema catalizzato al nichel. L'uso di catalizzatori al nichel ha consentito la formazione di elettrofili che si sono rivelati difficili per l'accoppiamento originale Suzuki che utilizza il palladio, inclusi substrati come fenoli, arileteri, esteri, fosfati e fluoruri.
L'indagine sull'accoppiamento incrociato catalizzato dal nichel è continuata e ha aumentato la portata della reazione dopo che questi primi esempi sono stati mostrati e l'interesse della ricerca è cresciuto. Miyaura e Inada hanno riferito nel 2000 che un catalizzatore di nichel più economico potrebbe essere utilizzato per il cross-coupling , utilizzando la trifenilfosfina (PPh 3 ) invece dei ligandi più costosi utilizzati in precedenza. Tuttavia, l'accoppiamento incrociato catalizzato da nichel richiedeva ancora carichi di catalizzatore elevati (3-10%), richiedeva un ligando in eccesso (1-5 equivalenti) ed era sensibile all'aria e all'umidità. I progressi di Han e collaboratori hanno cercato di affrontare questo problema sviluppando un metodo che utilizza basse quantità di catalizzatore di nichel (<1% in moli) e nessun equivalente aggiuntivo di legante.
È stato anche riferito da Wu e collaboratori nel 2011 che è stato possibile utilizzare un catalizzatore di nichel altamente attivo per l'accoppiamento incrociato di cloruri di arile che richiedeva solo lo 0,01-0,1% in moli di catalizzatore di nichel. Hanno anche dimostrato che il catalizzatore può essere riciclato fino a sei volte senza praticamente alcuna perdita di attività catalitica. Il catalizzatore era riciclabile perché era un catalizzatore di nanoparticelle di fosfina nichel (G 3 DenP-Ni) che era costituito da dendrimeri .
I vantaggi e gli svantaggi si applicano alle reazioni di accoppiamento di Suzuki sia al palladio che al nichel. Oltre al sistema di catalizzatori Pd e Ni, nella reazione di accoppiamento Suzuki sono state utilizzate fonti metalliche economiche e non tossiche come ferro e rame. Il gruppo di ricerca di Bedford e il gruppo di ricerca di Nakamura hanno lavorato a lungo sullo sviluppo della metodologia della reazione di accoppiamento Suzuki catalizzata dal ferro. Il rutenio è un'altra fonte di metallo che è stata utilizzata nella reazione di accoppiamento Suzuki.
Accoppiamento ammidico
La catalisi del nichel può costruire legami CC dalle ammidi. Nonostante la natura intrinsecamente inerte delle ammidi come sintoni, la seguente metodologia può essere utilizzata per preparare i legami CC. La procedura di accoppiamento è lieve e tollerante verso una miriade di gruppi funzionali, tra cui: ammine, chetoni, eterocicli, gruppi con protoni acidi. Questa tecnica può essere utilizzata anche per preparare molecole bioattive e per unire eterocicli in modi controllati attraverso accorti incroci sequenziali. Di seguito viene fornita una revisione generale dello schema di reazione.
La sintesi del composto legante la tubulina ( agente antiproliferativo ) è stata effettuata utilizzando trimetossiammide e un frammento eterociclico.
organoborani
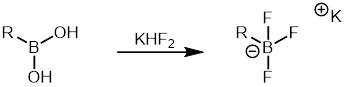
Gli acidi arilboronici sono relativamente più economici di altri organoborani ed è disponibile in commercio un'ampia varietà di acidi arilboronici . Quindi, è stato ampiamente utilizzato nella reazione di Suzuki come partner organoborano. I sali di ariltrifluoroborato sono un'altra classe di organoborani frequentemente utilizzati perché sono meno inclini alla protodeboronazione rispetto agli acidi arilboronici . Sono facili da sintetizzare e possono essere facilmente purificati. I sali di ariltrifluoroborato possono essere formati da acidi boronici mediante trattamento con acido fluoridrico di potassio che può poi essere utilizzato nella reazione di accoppiamento Suzuki.
Varianti del solvente
La reazione di accoppiamento Suzuki è diversa dalle altre reazioni di accoppiamento in quanto può essere eseguita in acqua organica bifasica, solo acqua o senza solvente. Ciò ha aumentato la portata delle reazioni di accoppiamento, poiché una varietà di basi solubili in acqua, sistemi catalitici e reagenti potrebbero essere utilizzati senza preoccuparsi della loro solubilità in solvente organico. L'uso dell'acqua come sistema solvente è interessante anche per i vantaggi economici e di sicurezza. Frequentemente utilizzati nei sistemi a solvente per l'accoppiamento Suzuki sono toluene , THF , diossano e DMF . Le basi più utilizzate sono K 2 CO 3 , KO t Bu , Cs 2 CO 3 , K 3 PO 4 , NaOH e NET 3 .
Guarda anche
- Accoppiamento Chan-Lam
- Diamine reazione
- Accoppiamento Hiyama
- Giunto Kumada
- Negishi accoppiamento
- Reazione di petasi
- Accoppiamento Sonogashira
- Reazione tranquilla
- Elenco delle reazioni organiche

![{\displaystyle {\ce {{\overset {organoboro\ specie}{R1-BY2}}+{\overset {alogenuro}{R2-X}}->[{} \atop {{\text{Pd}} \ sopra {\text{catalyst}}}][{\text{Base}}]R1-R2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c43b40292dc12a954f37f136ec4bfb39d595c3e1)