EZH2 - EZH2
Enhancer of zeste homolog 2 (EZH2) è un enzima istone-lisina N-metiltransferasi ( EC 2.1.1.43 ) codificato dal gene EZH2 , che partecipa alla metilazione dell'istone e, infine, alla repressione trascrizionale . EZH2 catalizza l'aggiunta di gruppi metilici di istone H3 a lisina 27, utilizzando il cofattore S-adenosil-L-metionina . L'attività di metilazione di EZH2 facilita la formazione dell'eterocromatina , quindi silenzia la funzione genica. Durante la mitosi cellulare è necessario anche il rimodellamento dell'eterocromatina cromosomica da parte di EZH2.
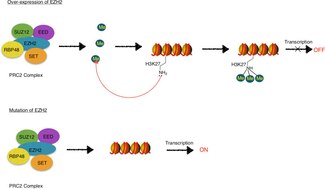
EZH2 è il componente enzimatico funzionale del Polycomb Repressive Complex 2 ( PRC2 ), responsabile del sano sviluppo embrionale attraverso il mantenimento epigenetico dei geni responsabili della regolazione dello sviluppo e della differenziazione . EZH2 è responsabile per l'attività di metilazione PRC2, e il complesso contiene anche proteine necessarie per la funzione ottimale ( EED , SUZ12 , JARID2 , AEBP2 , RbAp46 / 48 , e PCL ).
La mutazione o la sovraespressione di EZH2 è stata collegata a molte forme di cancro. EZH2 inibisce i geni responsabili della soppressione dello sviluppo del tumore e il blocco dell'attività di EZH2 può rallentare la crescita del tumore. EZH2 è stato preso di mira per l'inibizione perché è sovraregolato in più tumori inclusi, ma non limitati a, seno, prostata , melanoma e cancro alla vescica. Le mutazioni nel gene EZH2 sono anche associate alla sindrome di Weaver , una rara malattia congenita , ed EZH2 è coinvolto nel causare sintomi neurodegenerativi nel disturbo del sistema nervoso, atassia telangiectasia .
Funzione
| Istone-lisina N-metiltransferasi | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificatori | |||||||||
| CE n. | 2.1.1.43 | ||||||||
| Banche dati | |||||||||
| IntEnz | Vista IntEnz | ||||||||
| BRENDA | Ingresso BRENDA | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | Ingresso KEGG | ||||||||
| MetaCyc | passaggio metabolico | ||||||||
| PRIAM | profilo | ||||||||
| Strutture PDB | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
EZH2 è la subunità catalitica del Polycomb Repressive Complex 2 (PRC2). Attività catalitica di EZH2 basa sulla sua formazione di un complesso con almeno due componenti PRC2, SUZ12 e EED .
Come istone metiltransferasi (HMTase), la funzione primaria di EZH2 è quella di metilare Lys-27 sull'istone 3 (H3K27me) trasferendo un gruppo metilico dal cofattore S-adenosil-L-metionina (SAM). EZH2 è in grado di mono-, di- e tri- metilazione di H3K27 ed è stato associato a una varietà di funzioni biologiche, inclusa la regolazione trascrizionale nell'emopoiesi , nello sviluppo e nella differenziazione cellulare .
Recenti studi hanno indicato che EZH2 è anche in grado di metilare proteine non istoniche .
Repressione della trascrizione
EZH2, come parte della PRC2, catalizza la trimetilazione di H3K27 ( H3K27me3 ), che è una modifica dell'istone che è stata caratterizzata come parte del codice dell'istone . Il codice dell'istone è la teoria secondo cui le modificazioni chimiche, come la metilazione , l' acetilazione e l' ubiquitinazione , delle proteine dell'istone svolgono ruoli distintivi nella regolazione epigenetica della trascrizione genica . La catalisi mediata da EZH2 di H3K27me3 è associata alla repressione della trascrizione a lungo termine.
EZH2, così come altre proteine del gruppo Polycomb, sono coinvolte nello stabilire e mantenere la repressione genica attraverso la divisione cellulare . Si pensa che questo stato trascrizionale repressivo sia dovuto alla metilazione di H3K27 mediata da PRC2/EZH2-EED e al successivo reclutamento di PRC1 che facilita la condensazione della cromatina e la formazione di eterocromatina . L'eterocromatina è una cromatina compatta che limita l'accessibilità del meccanismo di trascrizione al DNA sottostante, sopprimendo così la trascrizione.
Durante la divisione cellulare, è necessaria la formazione di eterocromatina per una corretta segregazione dei cromosomi . Il complesso PRC2/EED-EZH2 può anche essere coinvolto nel reclutamento di DNA metiltransferasi ( DNMTs ), che si traduce in un aumento della metilazione del DNA , un altro strato epigenetico di repressione della trascrizione. Geni specifici che sono stati identificati come bersagli della repressione trascrizionale mediata da EZH2 includono HOXA9 , HOXC8 , MYT1 , CDKN2A e geni bersaglio dell'acido retinoico .
Attivazione della trascrizione
Nel cancro, EZH2 può svolgere un ruolo nell'attivazione della trascrizione, indipendentemente dalla PRC2 . Nelle cellule del cancro al seno, è stato dimostrato che EZH2 attiva i geni bersaglio NF-kB , che sono coinvolti nelle risposte agli stimoli. Il ruolo funzionale di questa attività e il suo meccanismo sono ancora sconosciuti.
Sviluppo e differenziazione cellulare
EZH2 svolge un ruolo essenziale nello sviluppo. In particolare, aiuta a controllare la repressione trascrizionale dei geni che regolano la differenziazione cellulare. Nelle cellule staminali embrionali, la trimetilazione di H3K27me3 mediata da EZH2 nelle regioni contenenti geni dello sviluppo sembra essere importante per il mantenimento della normale differenziazione cellulare. H3K27me3 è anche importante nel guidare l' inattivazione dell'X , il silenziamento di un cromosoma X nelle femmine durante lo sviluppo. Durante l'inattivazione dell'X, si pensa che EZH2 sia coinvolto nell'iniziare la formazione dell'eterocromatina mediante la trimetilazione di H3K27 e che altre metiltransferasi istoniche e segni di istoni possano essere coinvolti nel mantenimento dello stato silenziato.
Inoltre, EZH2 è stata identificata come una proteina essenziale coinvolti nello sviluppo e differenziazione delle cellule B e cellule T . H3K27me3 è coinvolto nella soppressione dei geni che promuovono la differenziazione, mantenendo così uno stato indifferenziato delle cellule B e T e svolgendo un ruolo importante nella regolazione dell'emopoiesi .
Regolazione dell'attività di EZH2
L'attività di EZH2 è regolata dalla fosforilazione post-traduzionale dei residui di treonina e serina su EZH2. In particolare, la fosforilazione di T350 è stata collegata a un aumento dell'attività di EZH2, mentre la fosforilazione di T492 e S21 è stata collegata a una diminuzione dell'attività di EZH2. È stato suggerito che la fosforilazione di T492 interrompa i contatti tra EZH2 umano e i suoi partner di legame nel complesso PRC2, ostacolando così la sua attività catalitica.
Oltre alla fosforilazione, è stato anche dimostrato che l'attività di PRC2/EZH2-EED è antagonizzata da segni istonici attivanti la trascrizione, come l' acetilazione di H3K27 ( H3K27ac ) e la metilazione di H3K36 ( H3K36me ).
Attività enzimatica
La funzione di EZH2 è fortemente dipendente dal suo reclutamento da parte del complesso PRC2. In particolare, lo sviluppo dell'ectoderma embrionale della proteina WD40-repeat (EED) e il soppressore della proteina a dito di zinco di zeste 12 (SUZ12) sono necessari per stabilizzare l'interazione di EZH2 con il suo substrato istonico Recentemente, sono state identificate due isoforme di EZH2 generate dallo splicing alternativo in umani: EZH2α e EZH2β. Entrambe le isoforme contengono elementi che sono stati identificati come importanti per la funzione EZH2, incluso il segnale di localizzazione nucleare , i siti di legame EED e SUZ12 e il dominio SET conservato. La maggior parte degli studi si è finora concentrata sull'isoforma più lunga EZH2α, ma EZH2β, che manca degli esoni 4 e 8, ha dimostrato di essere attivo. Inoltre, i complessi PRC2/EZH2β agiscono su geni distinti da quello della sua controparte PRC2/EZH2α suggerendo che ciascuna isoforma può agire per regolare uno specifico sottoinsieme di geni. Ulteriori prove suggeriscono che EZH2 può anche essere in grado di metilare la lisina indipendentemente dall'associazione con PRC2, quando EZH2 è altamente sovraregolato.
metilazione della lisina
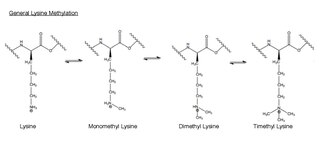
La metilazione è l'aggiunta di un -CH 3 , o gruppo metilico, a un'altra molecola. In biologia, la metilazione è tipicamente catalizzata da enzimi e i gruppi metilici vengono comunemente aggiunti alle proteine o agli acidi nucleici. Nella metilazione catalizzata da EZH2, l'amminoacido lisina nell'istone h3 è metilato. Questo residuo amminoacidico può essere metilato fino a tre volte sul suo gruppo ammonico terminale . Queste lisine metilate sono importanti nel controllo dell'espressione genica dei mammiferi e hanno un ruolo funzionale nella formazione dell'eterocromatina , nell'inattivazione del cromosoma X e nella regolazione trascrizionale. Nei cromosomi dei mammiferi, la metilazione dell'istone lisina può attivare o reprimere i geni a seconda del sito di metilazione. Lavori recenti hanno dimostrato che almeno parte della funzione di silenziamento del complesso EZH2 è la metilazione dell'istone H3 sulla lisina 27. La metilazione e altre modificazioni avvengono sugli istoni. Le modificazioni del metile possono influenzare il legame delle proteine a questi istoni e attivare o inibire la trascrizione .
Meccanismo di catalisi
EZH2 è un membro della famiglia del dominio SET delle metiltransferasi della lisina che funzionano per aggiungere gruppi metilici alle catene laterali della lisina delle proteine del substrato . Le metiltransferasi SET dipendono da un cofattore S-Adenosil metionina (SAM) per agire come donatore di metile per la loro attività catalitica. Le proteine del dominio SET differiscono dalle altre metiltransferasi dipendenti da SAM in quanto legano il loro substrato e il cofattore SAM sui lati opposti del sito attivo dell'enzima. Questo orientamento del substrato e del cofattore consente a SAM di dissociarsi senza interrompere il legame del substrato e può portare a più cicli di metilazione della lisina senza dissociazione del substrato.
Sebbene non sia stata determinata né una struttura cristallina legata al substrato né quella legata al SAM per EZH2, l'allineamento della struttura STAMP con la metiltransferasi umana SET7/9 mostra residui di tirosina conservati in posizioni quasi identiche all'interno del sito attivo putativo di EZH2.
In precedenza era stato suggerito che la tirosina 726 nel sito attivo EZH2 agisse come base generale per de-protonare il substrato lisina, ma gli effetti dell'isotopo cinetico hanno indicato che i residui del sito attivo non sono direttamente coinvolti nella chimica della reazione della metiltransferasi. Invece questi esperimenti supportano un meccanismo in cui i residui abbassano il pKa del residuo di lisina del substrato fornendo contemporaneamente un canale per consentire all'acqua di accedere alla catena laterale della lisina all'interno del sito attivo. L'acqua del solvente sfuso può quindi deprotonare facilmente la catena laterale della lisina, attivandola per l'attacco nucleofilo del cofattore SAM in una reazione simile a S N 2 con conseguente trasferimento del gruppo metilico da SAM alla catena laterale della lisina.
EZH2 catalizza principalmente la mono e dimetilazione di H3K27, ma una mutazione clinicamente rilevante del residuo tirosina 641 in fenilalanina (Y641F) determina una maggiore attività di trimetilazione di H3K27. Si propone che la rimozione del gruppo ossidrile su Y641 abroghi l'ingombro sterico e consenta l'accomodamento di un terzo gruppo metilico sul substrato lisina.
Significato clinico
Cancro
EZH2 è un bersaglio attraente per la terapia antitumorale perché aiuta le cellule cancerose a dividersi e proliferare. Si trova in quantità maggiori rispetto alle cellule sane in una vasta gamma di tumori, tra cui seno, della prostata, della vescica, dell'utero , e renali tumori, così come il melanoma e linfoma . EZH2 è un gene soppressore, quindi quando diventa sovraespresso, molti geni oncosoppressori che normalmente sono attivati, vengono disattivati. L'inibizione della funzione di EZH2 riduce i tumori maligni in alcuni casi segnalati perché quei geni oncosoppressori non sono messi a tacere da EZH2. EZH2 tipicamente non è espresso negli adulti sani; si trova solo nelle cellule in attiva divisione, come quelle attive durante lo sviluppo fetale. A causa di questa caratteristica, la sovraespressione di EZH2 può essere utilizzata come marker diagnostico del cancro e di alcune malattie neurodegenerative. Tuttavia, ci sono casi in cui è difficile dire se la sovraespressione di EZH2 sia la causa di una malattia o semplicemente una conseguenza. Se è solo una conseguenza, prendere di mira l'EZH2 per l'inibizione potrebbe non curare la malattia. Un esempio di percorso del cancro in cui EZH2 svolge un ruolo è il percorso pRB-E2F. È a valle della via pRB-E2F e i segnali di questa via portano alla sovraespressione di EZH2. Un'altra caratteristica importante di EZH2 è che quando EZH2 è sovraespresso, può attivare i geni senza formare PRC2 . Questo è un problema perché significa che l'attività di metilazione dell'enzima non è mediata dalla formazione di complessi. Nelle cellule del cancro al seno, EZH2 attiva i geni che promuovono la proliferazione e la sopravvivenza cellulare. Può anche attivare geni regolatori come c-myc e ciclina D1 interagendo con i fattori di segnalazione Wnt . È importante sottolineare che la mutazione della tirosina 641 nel dominio SET attivo in un numero di diversi amminoacidi è una caratteristica comune di alcuni linfomi a cellule B.
Inibitori
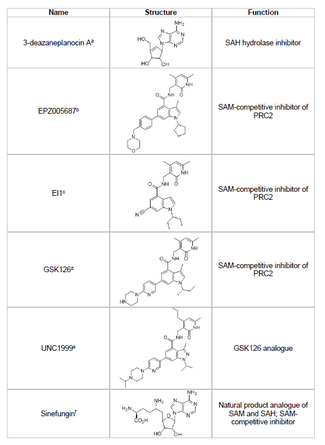
Lo sviluppo di un inibitore di EZH2 e la prevenzione della metilazione indesiderata dell'istone dei geni oncosoppressori è un'area praticabile della ricerca sul cancro. Lo sviluppo dell'inibitore EZH2 si è concentrato sul targeting del sito attivo del dominio SET della proteina. Diversi inibitori di EZH2 sono stati sviluppati a partire dal 2015, tra cui 3-deazaneplanocin A (DZNep), EPZ005687, EI1, GSK126 e UNC1999. DZNep ha potenziali proprietà antivirali e antitumorali perché abbassa i livelli di EZH2 e induce l' apoptosi nelle cellule del cancro al seno e al colon. DZNep inibisce l'idrolisi della S-adenosil-L-omocisteina (SAH), che è un inibitore a base di prodotto di tutte le proteine metiltransferasi, portando ad un aumento delle concentrazioni cellulari di SAH che a sua volta inibisce EZH2. Tuttavia, DZNep non è specifico per EZH2 e inibisce anche altre DNA metiltransferasi.
Nel 2012, una società chiamata Epizyme ha rivelato EPZ005687, un inibitore competitivo della S-adenosilmetionina ( SAM ) che è più selettivo di DZNep; ha un aumento di 50 volte della selettività per EZH2 rispetto a EZH1 . Il farmaco blocca l'attività di EZH2 legandosi al sito attivo del dominio SET dell'enzima. EPZ005687 può anche inibire i mutanti Y641 e A677 di EZH2, che possono essere applicabili per il trattamento del linfoma non Hodgkin. Nel 2013, Epizyme ha iniziato gli studi clinici di Fase I con un altro inibitore dell'EZH2 , tazemetostat (EPZ-6438), per i pazienti con linfoma a cellule B. Nel 2020, tazemetostat , con il nome commerciale Tazverik, è stato approvato dalla FDA per il trattamento del sarcoma epitelioide metastatico o localmente avanzato ed è stato approvato per il trattamento di pazienti con linfoma follicolare recidivante nello stesso anno.
Sinefungin è un altro inibitore competitivo SAM, tuttavia, come DZNep, non è specifico per EZH2. Funziona legandosi nella tasca di legame del cofattore delle DNA metiltransferasi per bloccare il trasferimento di metile. EI1 è un altro inibitore, sviluppato da Novartis , che ha mostrato attività inibitoria di EZH2 nelle cellule tumorali del linfoma, comprese le cellule con la mutazione Y641. Il meccanismo di questo inibitore coinvolge anche la competizione con il cofattore SAM per il legame con EZH2. GSK126 è un potente inibitore EZH2 competitivo SAM sviluppato da GlaxoSmithKline , che ha una selettività 150 volte superiore a EZH1 e un K i di 0,5-3 nM. UNC1999 è stato sviluppato come un analogo di GSK126 ed è stato il primo inibitore EZH2 biodisponibile per via orale a mostrare attività. Tuttavia, è meno selettivo della sua controparte GSK126 e si lega anche a EZH1, aumentando il potenziale di effetti fuori bersaglio.
Le terapie combinate sono allo studio come possibili trattamenti quando i trattamenti primari iniziano a fallire. L'etoposide , un inibitore della topoisomerasi , quando combinato con un inibitore EZH2, diventa più efficace per i tumori polmonari non a piccole cellule con mutazioni BRG1 ed EGFR . Tuttavia, l'EZH2 e la metilazione della lisina possono avere un'attività di soppressione del tumore, ad esempio nella sindrome mielodisplastica , indicando che l'inibizione di EZH2 potrebbe non essere utile in tutti i casi.
Sindrome di Weaver
Le mutazioni nel gene EZH2 sono state collegate alla sindrome di Weaver , una malattia rara caratterizzata da età ossea avanzata, macrocefalia e ipertelorismo . Il residuo di istidina nel sito attivo dell'EZH2 wild-type è stato mutato in tirosina in pazienti con diagnosi di sindrome di Weaver. La mutazione probabilmente interferisce con il legame del cofattore e causa l'interruzione della funzione naturale della proteina.
Distribuzione tassonomica

Enhancer di zeste (E(z)) è stato originariamente identificato in Drosophila melanogaster e i suoi omologhi di mammifero sono stati successivamente identificati e denominati EZH1 (enhancer di zeste omologo 1) ed EZH2 (enhancer di zeste omologo 2). EZH2 è altamente conservato attraverso l' evoluzione . Esso e i suoi omologhi svolgono ruoli essenziali nello sviluppo, nella differenziazione cellulare e nella divisione cellulare in piante, insetti, pesci e mammiferi. Il seguente albero tassonomico è una rappresentazione della distribuzione di EZH2 in un'ampia varietà di specie.
Guarda anche
Riferimenti
Ulteriori letture
- Zeidler M, Kleer CG (settembre 2006). "Il potenziatore della proteina del gruppo Polycomb di Zeste 2: i suoi legami con la riparazione del DNA e il cancro al seno". Giornale di istologia molecolare . 37 (5–7): 219–23. doi : 10.1007/s10735-006-9042-9 . PMID 16855786 . S2CID 2332105 .
- De Haan G, Gerrits A (giugno 2007). "Controllo epigenetico delle cellule staminali ematopoietiche che invecchiano il caso di Ezh2". Annali dell'Accademia delle Scienze di New York . 1106 (1): 233-9. doi : 10.1196/annals.1392.008 . PMID 17332078 . S2CID 25177748 .
- Hobert O, Jallal B, Ullrich A (giugno 1996). "Interazione di Vav con ENX-1, un presunto regolatore trascrizionale dell'espressione genica di homeobox" . Biologia molecolare e cellulare . 16 (6): 3066–73. doi : 10.1128/MCB.16.6.3066 . PMC 231301 . PMID 8649418 .
- Bonaldo MF, Lennon G, Soares MB (settembre 1996). "Normalizzazione e sottrazione: due approcci per facilitare la scoperta dei geni" . Ricerca sul genoma . 6 (9): 791-806. doi : 10.1101/gr.6.9.791 . PMID 8889548 .
- Abel KJ, Brody LC, Valdes JM, Erdos MR, McKinley DR, Castilla LH, Merajver SD, Couch FJ, Friedman LS, Ostermeyer EA, Lynch ED, King MC, Welcsh PL, Osborne-Lawrence S, Spillman M, Bowcock AM, Collins FS, Weber BL (ottobre 1996). "Caratterizzazione di EZH1, un omologo umano di Drosophila Enhancer di zeste vicino a BRCA1". Genomica . 37 (2): 161-71. doi : 10.1006/geno.1996.0537 . PMID 8921387 .
- Laible G, Wolf A, Dorn R, Reuter G, Nislow C, Lebersorger A, Popkin D, Pillus L, Jenuwein T (giugno 1997). "Mammiferi omologhi del gene del gruppo Polycomb Enhancer di zeste mediano il silenziamento genico nell'eterocromatina di Drosophila e nei telomeri di S. cerevisiae" . Il Giornale EMBO . 16 (11): 3219-32. doi : 10.1093/emboj/16.11.3219 . PMC 1169939 . PMID 9214638 .
- Cardoso C, Timsit S, Villard L, Khrestchatisky M, Fontès M, Colleaux L (aprile 1998). "Interazione specifica tra il prodotto del gene XNP/ATR-X e il dominio SET della proteina EZH2 umana" . Genetica Molecolare Umana . 7 (4): 679-84. doi : 10.1093/hmg/7.4.679 . PMID 9499421 .
- van Lohuizen M, Tijms M, Voncken JW, Schumacher A, Magnuson T, Wientjens E (giugno 1998). "Interazione di proteine del gruppo polycomb (Pc-G) di topo Enx1 e Enx2 con Eed: indicazione per complessi Pc-G separati" . Biologia molecolare e cellulare . 18 (6): 3572-9. doi : 10.1128/MCB.18.6.3572 . PMC 108938 . PMID 9584197 .
- Sewalt RG, van der Vlag J, Gunster MJ, Hamer KM, den Blaauwen JL, Satijn DP, Hendrix T, van Driel R, Otte AP (giugno 1998). "La caratterizzazione delle interazioni tra le proteine del gruppo polycomb dei mammiferi Enx1/EZH2 e EED suggerisce l'esistenza di diversi complessi proteici del gruppo polycomb dei mammiferi" . Biologia molecolare e cellulare . 18 (6): 3586–95. doi : 10.1128/mcb.18.6.3586 . PMC 108940 . PMID 9584199 .
- Denisenko O, Shnyreva M, Suzuki H, Bomsztyk K (ottobre 1998). "Le mutazioni puntiformi nel dominio WD40 di Eed bloccano la sua interazione con Ezh2" . Biologia molecolare e cellulare . 18 (10): 5634-42. doi : 10.1128/MCB.18.10.5634 . PMC 109149 . PMID 9742080 .
- van der Vlag J, Otte AP (dicembre 1999). "La repressione trascrizionale mediata dalla proteina EED del gruppo polycomb umano comporta la deacetilazione dell'istone". Genetica della natura . 23 (4): 474-8. doi : 10.1038/70602 . PMID 10581039 . S2CID 6748531 .
- Cardoso C, Mignon C, Hetet G, Grandchamps B, Fontes M, Colleaux L (marzo 2000). "Il gene EZH2 umano: organizzazione genomica e mappatura rivista in 7q35 all'interno della regione critica per i disordini mieloidi maligni" . Giornale europeo di genetica umana . 8 (3): 174–80. doi : 10.1038/sj.ejhg.5200439 . PMID 10780782 .
- Raaphorst FM, Otte AP, van Kemenade FJ, Blokzijl T, Fieret E, Hamer KM, Satijn DP, Meijer CJ (maggio 2001). "Distinti modelli di espressione BMI-1 ed EZH2 in timociti e cellule T mature suggeriscono un ruolo per i geni Polycomb nella differenziazione delle cellule T umane" . Giornale di immunologia . 166 (10): 5925-34. doi : 10.4049/jimmunol.166.10.5925 . PMID 11342607 .
- O'Connell S, Wang L, Robert S, Jones CA, Saint R, Jones RS (novembre 2001). "Le dita Polycomblike PHD mediano l'interazione conservata con il potenziatore della proteina zeste" . Il giornale di chimica biologica . 276 (46): 43065-73. doi : 10.1074/jbc.M104294200 . PMID 11571280 .
- Varambally S, Dhanasekaran SM, Zhou M, Barrette TR, Kumar-Sinha C, Sanda MG, Ghosh D, Pienta KJ, Sewalt RG, Otte AP, Rubin MA, Chinnaiyan AM (ottobre 2002). "La proteina del gruppo polycomb EZH2 è coinvolta nella progressione del cancro alla prostata" (PDF) . Natura . 419 (6907): 624-9. doi : 10.1038/nature01075 . hdl : 2027.42/62896 . PMID 12374981 . S2CID 4414767 .
- Kleer CG, Cao Q, Varambally S, Shen R, Ota I, Tomlins SA, Ghosh D, Sewalt RG, Otte AP, Hayes DF, Sabel MS, Livant D, Weiss SJ, Rubin MA, Chinnaiyan AM (settembre 2003). "EZH2 è un marker di carcinoma mammario aggressivo e promuove la trasformazione neoplastica delle cellule epiteliali mammarie" . Atti della National Academy of Sciences degli Stati Uniti d'America . 100 (20): 11606-11. doi : 10.1073/pnas.1933744100 . PMC 208805 . PMID 14500907 .