Tiroidite di Hashimoto - Hashimoto's thyroiditis
| Tiroidite di Hashimoto | |
|---|---|
| Altri nomi | Tiroidite linfocitica cronica, tiroidite autoimmune, struma linfomatosa, malattia di Hashimoto |
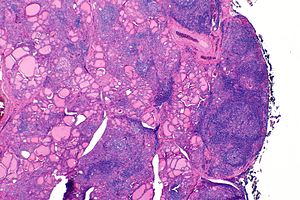 | |
| La tiroide di qualcuno con la tiroidite di Hashimoto vista con un microscopio a basso ingrandimento | |
| Specialità | Endocrinologia |
| Sintomi | Gozzo indolore , aumento di peso , sensazione di stanchezza , costipazione , depressione , pelle secca , perdita di capelli |
| complicazioni | Linfoma tiroideo . |
| Esordio normale | 30-50 anni |
| cause | Fattori genetici e ambientali . |
| Fattori di rischio | Storia familiare, un'altra malattia autoimmune |
| Metodo diagnostico | TSH , T4, autoanticorpi antitiroide |
| Diagnosi differenziale | Morbo di Graves , gozzo nodulare non tossico |
| Trattamento | Levotiroxina , chirurgia |
| Frequenza | 5% ad un certo punto |
La tiroidite di Hashimoto , nota anche come tiroidite linfocitica cronica e malattia di Hashimoto , è una malattia autoimmune in cui la ghiandola tiroidea viene gradualmente distrutta. All'inizio, i sintomi potrebbero non essere notati. Nel tempo, la tiroide può ingrossarsi, formando un gozzo indolore . Alcune persone alla fine sviluppano ipotiroidismo con aumento di peso , affaticamento , stitichezza , depressione , perdita di capelli e dolori generali. Dopo molti anni la tiroide in genere si riduce di dimensioni. Le potenziali complicanze includono il linfoma tiroideo .
Si pensa che la tiroidite di Hashimoto sia dovuta a una combinazione di fattori genetici e ambientali . I fattori di rischio includono una storia familiare della condizione e avere un'altra malattia autoimmune. La diagnosi è confermata dagli esami del sangue per TSH , T4 e autoanticorpi antitiroide . Altre condizioni che possono produrre sintomi simili includono la malattia di Graves e il gozzo nodulare non tossico .
La tiroidite di Hashimoto è tipicamente trattata con levotiroxina . Se l'ipotiroidismo non è presente, alcuni potrebbero non raccomandare alcun trattamento, mentre altri potrebbero trattare per cercare di ridurre le dimensioni del gozzo. Le persone colpite dovrebbero evitare di mangiare grandi quantità di iodio ; tuttavia, è necessaria una quantità sufficiente di iodio soprattutto durante la gravidanza. La chirurgia è raramente necessaria per trattare il gozzo.
La tiroidite di Hashimoto colpisce circa il 5% dei caucasici ad un certo punto della loro vita. In genere inizia tra i 30 ei 50 anni ed è molto più comune nelle donne rispetto agli uomini. I tassi della malattia sembrano essere in aumento. Fu descritta per la prima volta dal medico giapponese Hakaru Hashimoto nel 1912. Nel 1957 fu riconosciuta come una malattia autoimmune.
segni e sintomi
Molti sintomi sono attribuiti allo sviluppo della tiroidite di Hashimoto. I sintomi più comuni includono: affaticamento , aumento di peso, viso pallido o gonfio, sensazione di freddo, dolori articolari e muscolari , stitichezza , capelli secchi e diradati, flusso mestruale pesante o periodi irregolari , depressione , disturbo di panico , battito cardiaco rallentato e problemi rimanere incinta e mantenere la gravidanza.
La malattia di Hashimoto è circa sette volte più comune nelle donne che negli uomini. Può verificarsi negli adolescenti e nelle giovani donne, ma compare più comunemente nella mezza età, in particolare negli uomini. Le persone che sviluppano la malattia di Hashimoto hanno spesso membri della famiglia che hanno la tiroide o altre malattie autoimmuni e talvolta hanno altre malattie autoimmuni.
La tiroide può diventare solida, grande e lobulata nella tiroidite di Hashimoto, ma anche i cambiamenti nella tiroide possono essere non palpabili. L'ingrossamento della tiroide è dovuto all'infiltrazione linfocitaria e alla fibrosi , piuttosto che all'ipertrofia tissutale . Sebbene il loro ruolo nella distruzione iniziale dei follicoli non sia chiaro, gli anticorpi contro la perossidasi tiroidea o la tireoglobulina sono rilevanti, poiché servono come marcatori per rilevare la malattia e la sua gravità. Si pensa che siano i prodotti secondari della distruzione della ghiandola mediata dalle cellule T.
Esso si caratterizza anche per invasione del tessuto tiroideo da leucociti , soprattutto linfociti T . Una complicanza rara ma grave è il linfoma tiroideo , generalmente di tipo a cellule B, linfoma non-Hodgkin .
Fattori di rischio
La forte componente genetica è confermata da studi su gemelli monozigoti, con una concordanza del 38-55%, con una concordanza ancora maggiore di anticorpi tiroidei circolanti non in relazione alla presentazione clinica (fino all'80% nei gemelli monozigoti). Nessuno dei due risultati è stato osservato in misura simile nei gemelli dizigoti, offrendo un forte favore per l'elevata eziologia genetica.
Farmaci che influenzano la funzione tiroidea
Alcuni farmaci o farmaci sono stati associati all'alterazione e all'interferenza con la funzione tiroidea. Di questi farmaci, ci sono due principali meccanismi di interferenza che possono avere.
Uno dei meccanismi di interferenza è quando un farmaco altera le proteine di trasferimento del siero dell'ormone tiroideo. Estrogeni, tamoxifene, eroina, metadone, clofibrato, 5-fluorouracile, mitotano e perfenazina aumentano tutti la concentrazione di globulina legante la tiroide (TBG). Gli androgeni, gli steroidi anabolizzanti come il danazolo , i glucocorticoidi e l'acido nicotinico a lento rilascio riducono tutti le concentrazioni di TBG. Furosemide, fenoflenac, acido mefenamico, salicilati, fenitoina, diazepam, sulfoniluree, acidi grassi liberi ed eparina interferiscono con il legame dell'ormone tiroideo con TBG e/o transtiretina .
L'altro meccanismo che i farmaci possono utilizzare per interferire con la funzione tiroidea sarebbe quello di alterare il metabolismo extra-trioidale dell'ormone tiroideo. Il propiltiouracile, i glucocorticoidi, il propanololo, i mezzi di contrasto iodati, l'amiodarone e la clomipramina inibiscono tutti la conversione di T4 e T3. Fenobarbital, rifampicina, fenitoina e carbamazepina aumentano il metabolismo epatico. Infine, colestriamina, colestipolo, idrossido di alluminio, solfato ferroso e sucralfato sono tutti farmaci che riducono l'assorbimento di T4 o ne aumentano l'escrezione.
Geni HLA
Il primo locus genico associato alla malattia tiroidea autoimmune era la regione del complesso maggiore di istocompatibilità (MHC) sul cromosoma 6p21. Codifica gli HLA. Gli alleli HLA specifici hanno una maggiore affinità con i peptidi tiroidei autoantigenici e possono contribuire allo sviluppo di malattie tiroidee autoimmuni. In particolare, nella malattia di Hashimoto, è stata dimostrata un'espressione aberrante di HLA II sui tireociti. Possono presentare autoantigeni tiroidei e dare inizio a malattie autoimmuni della tiroide. Gli alleli di suscettibilità non sono coerenti nella malattia di Hashimoto. Nei caucasici, è stato riportato che vari alleli sono associati alla malattia, inclusi DR3, DR5 e DQ7.
Geni CTLA-4
Questo gene è il secondo principale gene immuno-regolatore correlato alla malattia autoimmune della tiroide. I polimorfismi del gene CTLA-4 possono contribuire alla ridotta inibizione della proliferazione delle cellule T e aumentare la suscettibilità alla risposta autoimmune. CTLA-4 è un importante gene di suscettibilità agli autoanticorpi tiroidei. Un collegamento della regione CTLA-4 alla presenza di autoanticorpi tiroidei è stato dimostrato da un'analisi di collegamento dell'intero genoma. CTLA-4 è stato confermato come il locus principale per gli autoanticorpi tiroidei.
Gene della proteina tirosina fosfatasi non recettore di tipo 22
PTPN22 è il gene immunoregolatore identificato più di recente associato alla malattia autoimmune della tiroide. Si trova sul cromosoma 1p13 ed è espresso nei linfociti. Agisce come regolatore negativo dell'attivazione delle cellule T. La mutazione in questo gene è un fattore di rischio per molte malattie autoimmuni. Un segnale più debole delle cellule T può portare a una ridotta delezione timica delle cellule T autoreattive e una maggiore funzione di PTPN22 può comportare l'inibizione delle cellule T regolatorie, che proteggono dall'autoimmunità.
L'IFN-γ promuove la citotossicità cellulo-mediata contro la tiroide. Le mutazioni che causano un aumento della produzione di IFN-γ sono state associate alla gravità dell'ipotiroidismo. L'ipotiroidismo grave è associato a mutazioni che portano a una minore produzione di IL-4 (citochina Th2 che sopprime l'autoimmunità cellulo-mediata), a una minore secrezione di TGF-β (inibitore della produzione di citochine) e a mutazioni di FoxP3, un fattore regolatore essenziale per lo sviluppo delle Tregs . Lo sviluppo della malattia di Hashimoto è stato associato alla mutazione del gene per il TNF-α (stimolatore della produzione di IFN-γ), causando la sua maggiore concentrazione.
I fattori ambientali prevenibili, tra cui l'elevata assunzione di iodio, la carenza di selenio e le malattie infettive e alcuni farmaci, sono stati implicati nello sviluppo di malattie autoimmuni della tiroide in individui geneticamente predisposti.
Iodio
L'eccessiva assunzione di iodio è un fattore ambientale ben noto per l'attivazione dell'autoimmunità tiroidea. Una maggiore prevalenza di autoanticorpi tiroidei è nelle aree con maggiore apporto di iodio. Sono stati proposti diversi meccanismi attraverso i quali lo iodio può promuovere l'autoimmunità tiroidea. L'esposizione allo iodio porta a una maggiore iodio della tireoglobulina, aumentandone l'immunogenicità creando nuovi epitopi contenenti iodio o esponendo epitopi criptici. Può facilitare la presentazione da parte dell'APC, aumentare l'affinità di legame del recettore delle cellule T e attivare cellule T specifiche.
È stato dimostrato che l'esposizione allo iodio aumenta il livello delle specie reattive dell'ossigeno. Migliorano l'espressione della molecola di adesione intracellulare-1 sulle cellule follicolari tiroidee, che potrebbero attirare le cellule immunocompetenti nella ghiandola tiroidea.
Lo iodio è tossico per i tireociti poiché specie altamente reattive dell'ossigeno possono legarsi ai lipidi e alle proteine della membrana. Provoca danni ai tireociti e il rilascio di autoantigeni. Lo iodio promuove anche l'apoptosi delle cellule follicolari e ha un'influenza sulle cellule immunitarie (aumento della maturazione delle cellule dendritiche, aumento del numero di cellule T, stimolazione della produzione di immunoglobuline delle cellule B).
I dati di The Danish Investigation of Iodio Intake and Thyroid Disease mostrano che all'interno di due coorti (maschi, femmine) con carenza di iodio moderata e lieve, i livelli sia di perossidasi tiroidea che di anticorpi della tireoglobulina sono più alti nelle femmine e i tassi di prevalenza di entrambi gli anticorpi aumentano con età.
Genere
Lo studio su gemelli danesi sani divisi in tre gruppi (monozigoti e dizigoti dello stesso sesso e coppie di gemelli di sesso opposto) ha stimato che il contributo genetico alla suscettibilità agli anticorpi della perossidasi tiroidea era del 61% nei maschi e del 72% nelle femmine e il contributo alla suscettibilità agli anticorpi della tireoglobulina era di 39 % nei maschi e 75% nelle femmine.
L'elevata predominanza femminile nell'autoimmunità tiroidea può essere associata al cromosoma X. Contiene geni legati al sesso e al sistema immunitario responsabili della tolleranza immunitaria. Una maggiore incidenza di autoimmunità tiroidea è stata riportata in pazienti con un tasso più elevato di monosomia del cromosoma X nei globuli bianchi periferici.
Un altro potenziale meccanismo potrebbe essere l'inattivazione distorta del cromosoma X, che porta alla fuga degli antigeni del sé legati all'X dalla presentazione nel timo e alla perdita della tolleranza delle cellule T.
Avere altre malattie autoimmuni è un fattore di rischio per lo sviluppo della tiroidite di Hashimoto, ed è vero anche il contrario. Le malattie autoimmuni più comunemente associate alla tiroidite di Hashimoto includono la celiachia , il diabete di tipo 1 , la vitiligine e l' alopecia .
I geni implicati variano nei diversi gruppi etnici e l'incidenza è aumentata nelle persone con disturbi cromosomici, comprese le sindromi di Turner , Down e Klinefelter solitamente associate ad autoanticorpi contro la tireoglobulina e la tireoperossidasi . La progressiva deplezione di queste cellule come risposta immunitaria citotossica porta a gradi più elevati di ipotiroidismo primario, presentandosi con bassi livelli di T3/T4 e aumenti compensatori di TSH.
Fisiopatologia
Sono stati suggeriti molteplici meccanismi attraverso i quali si sviluppa la patologia della tiroidite di Hashimoto.
Possono essere presenti vari autoanticorpi contro la perossidasi tiroidea , la tireoglobulina e i recettori del TSH , sebbene una piccola percentuale di persone possa non avere nessuno di questi anticorpi. Come indicato in vari studi sui gemelli, una percentuale della popolazione può anche avere questi anticorpi senza sviluppare la tiroidite di Hashimoto. Tuttavia, la citotossicità cellulo-dipendente e anticorpo è un fattore sostanziale alla base della ricaduta apoptotica della tiroidite di Hashimoto. L'attivazione dei linfociti T citotossici ( CD8 + cellule T) in risposta alla risposta immunitaria cellulo-mediata influenzata dai linfociti T helper ( CD4 + cellule T) è fondamentale per la distruzione dei tireociti. Come è caratteristico delle ipersensibilità di tipo IV , il reclutamento di macrofagi è un altro effetto dell'attivazione dei linfociti T helper, con i linfociti dell'asse Th1 che producono citochine infiammatorie all'interno del tessuto tiroideo per un'ulteriore attivazione dei macrofagi e migrazione nella ghiandola tiroidea per effetto diretto.
Grossi cambiamenti morfologici all'interno della tiroide sono visibili nell'ingrossamento generale, che è molto più localmente nodulare e irregolare rispetto a modelli più diffusi (come quello dell'ipertiroidismo ). Mentre la capsula è intatta e la ghiandola stessa è ancora distinta dal tessuto circostante, l'esame microscopico può fornire un'indicazione più rivelatrice del livello di danno.
Istologicamente, l'ipersensibilità è vista come una diffusa infiltrazione parenchimale da parte dei linfociti, in particolare delle cellule B plasmatiche , che spesso possono essere visti come follicoli linfoidi secondari (centri germinali, da non confondere con i follicoli pieni di colloidi normalmente presenti che costituiscono la tiroide). L'atrofia dei corpi colloidali è rivestita dalle cellule di Hürthle , cellule con citoplasma granulare intensamente eosinofilo , una metaplasia delle normali cellule cuboidali che costituiscono il rivestimento dei follicoli tiroidei. L'atrofia tiroidea grave si presenta spesso con bande fibrotiche più dense di collagene che rimangono entro i confini della capsula tiroidea.
Diagnosi
La diagnosi viene solitamente effettuata rilevando livelli elevati di anticorpi anti-perossidasi tiroidea nel siero, ma è possibile anche una tiroidite sieronegativa (senza autoanticorpi circolanti).
Dati i sintomi relativamente aspecifici dell'ipotiroidismo iniziale, la tiroidite di Hashimoto viene spesso erroneamente diagnosticata come depressione , ciclotimia , sindrome premestruale , sindrome da stanchezza cronica , fibromialgia e, meno frequentemente, come disfunzione erettile o disturbo d'ansia . Ad un esame grossolano, spesso si presenta un gozzo duro che non è doloroso al tatto; altri sintomi osservati con l'ipotiroidismo, come il mixedema periorbitale , dipendono dall'attuale stato di progressione della risposta, soprattutto in considerazione dello sviluppo solitamente graduale di ipotiroidismo clinicamente rilevante. Il test per l'ormone stimolante la tiroide (TSH), T3 libero, T4 libero e gli anticorpi antitireoglobulina (anti-Tg), gli anticorpi antiperossidasi tiroidea (anti-TPO o Ab TPO) e gli anticorpi antimicrosomiali possono aiutare a ottenere una diagnosi accurata. Una valutazione precoce della persona può presentare livelli elevati di tireoglobulina a causa di tireotossicosi transitoria , poiché l'infiammazione all'interno della tiroide causa danni all'integrità del deposito di tireoglobulina nel follicolo tiroideo; La secrezione di TSH dall'ipofisi anteriore aumenta in risposta a una diminuzione dell'inibizione del feedback negativo secondaria alla diminuzione degli ormoni tiroidei sierici. In genere, T4 è il test dell'ormone tiroideo preferito per l'ipotiroidismo. Si pensa che questa esposizione del corpo a quantità sostanziali di enzimi tiroidei precedentemente isolati contribuisca all'esacerbazione della rottura della tolleranza, dando origine ai sintomi più pronunciati osservati più tardi nella malattia. L'infiltrazione linfocitaria dei tessuti associati ai tireociti spesso porta alla scoperta istologicamente significativa dello sviluppo del centro germinativo all'interno della ghiandola tiroidea.
La sindrome di Hashimoto quando si presenta come mania è nota come sindrome di Prasad da Ashok Prasad, lo psichiatra che per primo la descrisse.
Trattamento
Gestire i livelli ormonali
L'ipotiroidismo causato dalla tiroidite di Hashimoto viene trattato con agenti sostitutivi dell'ormone tiroideo come levotiroxina , triiodotironina o estratto di tiroide essiccato . Una compressa presa una volta al giorno mantiene generalmente normali i livelli di ormone tiroideo. Nella maggior parte dei casi, il trattamento deve essere preso per il resto della vita della persona. Se l'ipotiroidismo è causato dalla tiroidite di Hashimoto, si può raccomandare di mantenere i livelli di TSH al di sotto di 3,0 m UI /l.
Prognosi
La disfunzione tiroidea conclamata e sintomatica è la complicanza più comune, con circa il 5% delle persone con ipotiroidismo subclinico e tiroidite autoimmune cronica che progredisce in insufficienza tiroidea ogni anno. Talvolta si verificano periodi transitori di tireotossicosi (iperattività della tiroide), e raramente la malattia può progredire fino alla malattia di Graves ipertiroidea completa con orbitopatia attiva (occhi gonfi e infiammati). Rari casi di tiroidite fibrosa autoimmune si presentano con grave mancanza di respiro e difficoltà a deglutire , simili a tumori tiroidei aggressivi, ma tali sintomi migliorano sempre con la chirurgia o la terapia con corticosteroidi. Il linfoma primitivo a cellule B della tiroide colpisce meno di una persona su 1000 ed è più probabile che colpisca quelle con tiroidite autoimmune di vecchia data.
Epidemiologia
Si pensa che questo disturbo sia la causa più comune di ipotiroidismo primario in Nord America; come causa di gozzo non endemico, è tra le più comuni. La tiroidite di Hashimoto colpisce circa il 5% dei caucasici ad un certo punto della loro vita. Negli Stati Uniti colpisce meno afroamericani, ma è legato a una maggiore mortalità nella popolazione afroamericana. È anche meno frequente nelle popolazioni asiatiche. Circa 1,0-1,5 persone su 1000 hanno questa malattia in qualsiasi momento. Si verifica tra le otto e le 15 volte più spesso nelle donne che negli uomini. Sebbene possa verificarsi a qualsiasi età, compresi i bambini, è più frequente nelle donne tra i 30 ei 60 anni. Alcune ricerche suggeriscono una connessione al ruolo della placenta come spiegazione per la differenza di sesso.
È più comune nelle regioni ad alto apporto alimentare di iodio e tra le persone geneticamente suscettibili.
Storia
Conosciuta anche come malattia di Hashimoto, la tiroidite di Hashimoto prende il nome dal medico giapponese Hakaru Hashimoto (1881-1934) della scuola di medicina dell'Università di Kyushu , che per primo descrisse i sintomi delle persone con struma linfomatosa , un'intensa infiltrazione di linfociti all'interno della tiroide, nel 1912 nella rivista tedesca Archiv für Klinische Chirurgie . Questo articolo era composto da 30 pagine e 5 illustrazioni che descrivevano tutte le alterazioni istologiche del tessuto tiroideo. Inoltre, tutti i risultati del suo primo studio sono stati raccolti da quattro donne. Questi risultati hanno spiegato le caratteristiche patologiche osservate in queste donne, in particolare l'infiltrazione di cellule linfoidi e plasmatiche, nonché la formazione di follicoli linfoidi con centri germinativi, fibrosi, cellule epiteliali tiroidee degenerate e leucociti nel lume. Ha descritto questi tratti come istologicamente simili a quelli della malattia di Mikulic. Come accennato in precedenza, una volta scoperti questi tratti in questa nuova malattia, chiama la malattia struma linfomatosa. Questa malattia enfatizzava l'infiltrazione delle cellule linfoidi e la formazione dei follicoli linfoidi con centri germinativi, nessuno dei quali era mai stato riportato in precedenza.
Nonostante la scoperta e la pubblicazione del Dr.Hashimoto, la malattia purtroppo non è stata riconosciuta come distinta dalla tiroidite di Reidel che era una malattia comune a quel tempo in Europa. Sebbene molti altri articoli siano stati riportati e pubblicati da altri ricercatori, lo struma linfomatosa di Hashimoto è stato riconosciuto solo come una fase iniziale della tiroidite di Reidel nei primi anni del 1900. Non è stato fino al 1931 che la malattia è stata riconosciuta come una malattia a sé stante quando i ricercatori Allen Graham et al di Cleveland hanno riportato i suoi sintomi e la presentazione nello stesso modo dettagliato di Hakuru.
Nel 1956, i dottori Rose e Witebsky furono in grado di dimostrare come l'immunizzazione di alcuni roditori con estratti della tiroide di altri roditori assomigliasse alla malattia che Hakuru e altri ricercatori stavano cercando di descrivere. Questi medici sono stati anche in grado di descrivere gli anticorpi anti-tireoglobulina nei campioni di siero di sangue di questi stessi animali.
Più tardi, nello stesso anno, i ricercatori del Middlesex Hospital di Londra furono in grado di eseguire esperimenti sull'uomo su pazienti che presentavano sintomi simili. Hanno purificato l'anticorpo anti-tireoglobulina dal loro siero e sono stati in grado di concludere che questi pazienti malati hanno una reazione immunologica alla tireoglobulina umana. Da questi dati, è stato proposto che lo struma di Hashimoto potrebbe essere una malattia autoimmune della ghiandola tiroidea.
Nel 1957 è stata riconosciuta come una malattia autoimmune ed è stata la prima malattia autoimmune organo-specifica identificata.
A seguito di questo riconoscimento, gli stessi ricercatori del Middlesex Hospital pubblicarono un articolo nel 1962 su Lancet che finì per includere un ritratto di Hakuru Hashimoto. La malattia è stata in grado di diventare molto più nota da quel momento e la malattia di Hashimoto è diventata più frequente nei libri di testo.
Da quelle scoperte, è stato possibile scoprire un certo numero di malattie autoimmuni, molte delle quali hanno a che fare con anticorpi specifici della tiroide.
Gravidanza
Le donne in gravidanza che sono positive alla tiroidite di Hashimoto possono avere una ridotta funzione tiroidea o la ghiandola può fallire completamente. Se una donna è TPOAb-positiva, i medici possono informarla dei rischi per sé e per il suo bambino se la malattia non viene curata. "Gli anticorpi della perossidasi tiroidea (TPOAb) vengono rilevati nel 10% delle donne in gravidanza", il che presenta rischi per quelle gravidanze. Le donne che hanno una funzione tiroidea bassa che non è stata stabilizzata sono a maggior rischio di avere un bambino con: basso peso alla nascita, distress respiratorio neonatale, idrocefalo , ipospadia , aborto spontaneo e parto prematuro. Il tasso di trapianto di embrioni e gli esiti di gravidanza di successo sono migliorati quando viene trattato il morbo di Hashimoto. Le raccomandazioni sono di trattare le donne in gravidanza solo se sono TPOAb-positive durante l'intera gravidanza e di sottoporre a screening tutte le donne in gravidanza per i livelli della tiroide. La stretta collaborazione tra l'endocrinologo e l'ostetrico avvantaggia la donna e il bambino. La Endocrine Society raccomanda lo screening nelle donne in gravidanza considerate ad alto rischio di malattie autoimmuni tiroidee.
Il test degli anticorpi per i perossidi tiroidei è raccomandato per le donne che sono mai state incinte, indipendentemente dall'esito della gravidanza. "...[P]la gravidanza precedente gioca un ruolo importante nello sviluppo dell'ipotiroidismo autoimmune manifesto nelle donne in premenopausa e il numero di gravidanze precedenti dovrebbe essere preso in considerazione quando si valuta il rischio di ipotiroidismo in una giovane donna [ sic ]."
I cambiamenti ormonali e l'espressione del trofoblasto di molecole immunomodulanti chiave portano all'immunosoppressione e alla tolleranza fetale. I principali attori nella regolazione della risposta immunitaria sono le Tregs. Le risposte immunitarie sia cellulo-mediate che umorali sono attenuate, con conseguente tolleranza immunitaria e soppressione dell'autoimmunità. È stato riportato che durante la gravidanza i livelli di perossidasi tiroidea e anticorpi anti tireoglobulina diminuiscono. Dopo il parto, le Treg diminuiscono rapidamente e le risposte immunitarie si ristabiliscono. Può portare all'insorgenza o all'aggravamento della malattia tiroidea autoimmune. Fino al 50% delle donne con anticorpi anti-perossidasi tiroidea all'inizio della gravidanza, l'autoimmunità tiroidea nel periodo postpartum si aggrava sotto forma di tiroidite postpartum. Nelle donne con tiroidite postpartum è stata riportata una maggiore secrezione di IFN-γ e IL-4 e una minore concentrazione plasmatica di cortisolo durante la gravidanza rispetto alle donne sane. Indica che un'immunosoppressione più debole durante la gravidanza potrebbe contribuire alla disfunzione tiroidea postpartum.
Microchimerismo fetale
Diversi anni dopo il parto, le cellule maschili chimeriche possono essere rilevate nel sangue periferico materno, nella tiroide, nei polmoni, nella pelle o nei linfonodi. Le cellule immunitarie fetali nella tiroide materna possono attivarsi e agire come un innesco che può avviare o aggravare la malattia tiroidea autoimmune. Nei pazienti con malattia di Hashimoto, le cellule microchimeriche fetali sono state rilevate nella tiroide in numero significativamente più elevato rispetto alle femmine sane.
Guarda anche
Riferimenti
| Classificazione | |
|---|---|
| Risorse esterne |

