Eredità epigenetica transgenerazionale - Transgenerational epigenetic inheritance
L'ereditarietà epigenetica transgenerazionale è la trasmissione di marcatori epigenetici da un organismo all'altro (cioè da genitore a figlio) che influenza i tratti della prole senza alterare la struttura primaria del DNA (cioè la sequenza dei nucleotidi), in altre parole, epigeneticamente . Il termine meno preciso "ereditarietà epigenetica" può coprire sia il trasferimento di informazioni cellula-cellula che organismo-organismo. Sebbene questi due livelli di eredità epigenetica siano equivalenti negli organismi unicellulari , possono avere meccanismi distinti e distinzioni evolutive negli organismi multicellulari .
I fattori ambientali possono indurre i segni epigenetici (tag epigenetici) per alcuni tratti influenzati epigeneticamente, mentre alcuni segni sono ereditari, portando così alcuni a ritenere che con l'epigenetica, la biologia moderna non rifiuta più l' ereditarietà dei caratteri acquisiti (lamarckismo) così fortemente come una volta fatto.
Categorie epigenetiche
Sono note quattro categorie generali di modificazione epigenetica:
- loop metabolici autosufficienti, in cui un mRNA o un prodotto proteico di un gene stimola la trascrizione del gene; es . gene Wor1 in Candida albicans ;
- modelli strutturali in cui le strutture vengono replicate utilizzando un modello o una struttura di impalcatura sul genitore; es. l'orientamento e l'architettura delle strutture citoscheletriche, ciglia e flagelli, prioni , proteine che si replicano modificando la struttura delle proteine normali in modo che corrispondano alle proprie;
- segni di cromatina , in cui gruppi metilici o acetilici si legano a nucleotidi o istoni del DNA alterando così i modelli di espressione genica; es . gene Lcyc in Linaria vulgaris descritto di seguito;
- silenziamento dell'RNA , in cui piccoli filamenti di RNA interferiscono ( RNAi ) con la trascrizione del DNA o la traduzione dell'mRNA; noto solo da pochi studi, per lo più in Caenorhabditis elegans .
Ereditarietà dei segni epigenetici
Sebbene esistano varie forme di ereditarietà dei marcatori epigenetici, l'ereditarietà dei marcatori epigenetici può essere riassunta come la diffusione dell'informazione epigenetica per mezzo della linea germinale. Inoltre, la variazione epigenetica assume tipicamente una delle quattro forme generali, sebbene vi siano altre forme che devono ancora essere chiarite. Attualmente, cicli di feedback autosufficienti, modelli spaziali, marcatura della cromatina e percorsi mediati da RNA modificano gli epigeni delle singole cellule. La variazione epigenetica all'interno degli organismi multicellulari è endogena o esogena. L'endogeno è generato dalla segnalazione cellula-cellula (ad esempio durante la differenziazione cellulare all'inizio dello sviluppo), mentre l'esogeno è una risposta cellulare agli stimoli ambientali.
Rimozione vs. ritenzione
Negli organismi che si riproducono sessualmente, gran parte della modificazione epigenetica all'interno delle cellule viene ripristinata durante la meiosi (es. segni nel locus FLC che controllano la vernalizzazione delle piante), sebbene alcune risposte epigenetiche si siano conservate (es. metilazione del trasposone nelle piante). L'ereditarietà differenziale dei segni epigenetici dovuta a pregiudizi materne o paterni sottostanti nei meccanismi di rimozione o ritenzione può portare all'assegnazione della causa epigenetica ad alcuni effetti genitoriali di origine negli animali e nelle piante.
Riprogrammare
Nei mammiferi, i segni epigenetici vengono cancellati durante due fasi del ciclo di vita. In primo luogo subito dopo la fecondazione e in secondo luogo, nelle cellule germinali primordiali in via di sviluppo, i precursori dei futuri gameti. Durante la fecondazione i gameti maschili e femminili si uniscono in diversi stati del ciclo cellulare e con diversa configurazione del genoma. I segni epigenetici del maschio sono rapidamente diluiti. Innanzitutto, le protamine associate al DNA maschile vengono sostituite con istoni dal citoplasma femminile , la maggior parte dei quali sono acetilati a causa della maggiore abbondanza di istoni acetilati nel citoplasma femminile o attraverso il legame preferenziale del DNA maschile agli istoni acetilati. In secondo luogo, il DNA maschile è sistematicamente demetilato in molti organismi, probabilmente attraverso la 5-idrossimetilcitosina . Tuttavia, alcuni segni epigenetici, in particolare la metilazione del DNA materno, possono sfuggire a questa riprogrammazione; che porta all'imprinting dei genitori.
Nelle cellule germinali primordiali (PGC) c'è una cancellazione più ampia delle informazioni epigenetiche. Tuttavia, alcuni siti rari possono anche eludere la cancellazione della metilazione del DNA. Se i segni epigenetici sfuggono alla cancellazione durante gli eventi di riprogrammazione sia zigotica che PGC, ciò potrebbe consentire l'ereditarietà epigenetica transgenerazionale.
Il riconoscimento dell'importanza della programmazione epigenetica per stabilire e fissare l'identità della linea cellulare durante l'embriogenesi precoce ha recentemente stimolato l'interesse per la rimozione artificiale della programmazione epigenetica. Le manipolazioni epigenetiche possono consentire il ripristino della totipotenza nelle cellule staminali o nelle cellule più in generale, generalizzando così la medicina rigenerativa .
Ritenzione
I meccanismi cellulari possono consentire la co-trasmissione di alcuni segni epigenetici. Durante la replicazione, le DNA polimerasi che lavorano sui filamenti principali e in ritardo sono accoppiate dall'antigene nucleare cellulare proliferante del fattore di processività del DNA (PCNA), che è stato anche implicato nel patterning e nella diafonia del filamento che consente la fedeltà di copia dei segni epigenetici. Il lavoro sulla fedeltà della copia della modifica dell'istone è rimasto nella fase del modello, ma i primi sforzi suggeriscono che le modifiche dei nuovi istoni sono modellate su quelle dei vecchi istoni e che gli istoni nuovi e vecchi si inseriscono casualmente tra i due filamenti di DNA figli. Per quanto riguarda il trasferimento alla generazione successiva, molti segni vengono rimossi come descritto sopra. Gli studi emergenti stanno trovando modelli di conservazione epigenetica attraverso le generazioni. Ad esempio, i satelliti centromerici resistono alla demetilazione. Il meccanismo responsabile di questa conservazione non è noto, sebbene alcune prove suggeriscano che la metilazione degli istoni possa contribuire. È stata anche identificata la disregolazione dei tempi di metilazione del promotore associata alla disregolazione dell'espressione genica nell'embrione.
Decadimento
Mentre il tasso di mutazione in un dato gene a 100 basi può essere 10 -7 per generazione, gli epigeni possono "mutare" più volte per generazione o possono essere fissati per molte generazioni. Ciò solleva la domanda: i cambiamenti nelle frequenze epigene costituiscono un'evoluzione? Gli effetti epigenetici in rapido decadimento sui fenotipi (vale a dire che durano meno di tre generazioni) possono spiegare alcune delle variazioni residue nei fenotipi dopo aver tenuto conto del genotipo e dell'ambiente. Tuttavia, distinguere questi effetti a breve termine dagli effetti dell'ambiente materno sull'ontogenesi precoce rimane una sfida.
Contributo ai fenotipi
L'importanza relativa dell'ereditarietà genetica ed epigenetica è oggetto di dibattito. Sebbene siano stati pubblicati centinaia di esempi di modificazione epigenetica dei fenotipi, pochi studi sono stati condotti al di fuori dell'ambiente di laboratorio. Pertanto, le interazioni di geni ed epigeni con l'ambiente non possono essere dedotte nonostante il ruolo centrale dell'ambiente nella selezione naturale. Le metodologie sperimentali per manipolare i meccanismi epigenetici sono nascenti (ad esempio) e avranno bisogno di dimostrazioni rigorose prima che siano fattibili studi che testano esplicitamente i contributi relativi del genotipo, dell'ambiente e dell'epigenotipo.
Nelle piante

Gli studi sull'ereditarietà epigenetica transgenerazionale nelle piante sono stati segnalati già negli anni '50. Uno dei primi e meglio caratterizzati esempi di ciò è la paramutazione b1 nel mais. Il gene b1 codifica per un fattore di trascrizione elica-ansa-elica di base che è coinvolto nella via di produzione degli antociani . Quando viene espresso il gene b1, la pianta accumula antociani all'interno dei suoi tessuti, portando a una colorazione viola di quei tessuti. L'allele BI (per B-Intense) ha un'alta espressione di b1 con conseguente pigmentazione scura dei tessuti della guaina e della buccia mentre l'allele B' (pronunciato B-prime) ha una bassa espressione di b1 con conseguente bassa pigmentazione in quei tessuti. Quando i genitori omozigoti BI vengono incrociati con l'omozigote B', i figli F1 risultanti mostrano tutti una bassa pigmentazione dovuta al silenziamento genico di b1. Inaspettatamente, quando le piante F1 sono auto-incrociate, la generazione F2 risultante mostra tutte una bassa pigmentazione e ha bassi livelli di espressione di b1. Inoltre, quando una qualsiasi pianta F2 (comprese quelle che sono geneticamente omozigoti per BI) viene incrociata con una BI omozigote, la prole mostrerà tutti una bassa pigmentazione ed espressione di b1. La mancanza di individui con pigmentazione scura nella progenie F2 è un esempio di eredità non mendeliana e ulteriori ricerche hanno suggerito che l'allele BI viene convertito in B' tramite meccanismi epigenetici. Gli alleli B' e BI sono considerati epialleli perché sono identici a livello di sequenza del DNA ma differiscono nel livello di metilazione del DNA , nella produzione di siRNA e nelle interazioni cromosomiche all'interno del nucleo. Inoltre, le piante difettose nei componenti della via di metilazione del DNA diretta dall'RNA mostrano un'aumentata espressione di b1 negli individui B' simile a quella di BI, tuttavia, una volta ripristinati questi componenti, la pianta ritorna allo stato di bassa espressione. Sebbene sia stata osservata una conversione spontanea da BI a B', non è mai stata osservata un'inversione da B' a BI (dal verde al viola) in 50 anni e migliaia di piante in esperimenti sia in serra che sul campo.
Sono stati riportati anche esempi di eredità epigenetica transgenerazionale indotta dall'ambiente nelle piante. In un caso, le piante di riso che sono state esposte a trattamenti di simulazione della siccità hanno mostrato una maggiore tolleranza alla siccità dopo 11 generazioni di esposizione e propagazione per discendenza di un singolo seme rispetto alle piante non trattate con siccità. Le differenze nella tolleranza alla siccità sono state collegate ai cambiamenti direzionali nei livelli di metilazione del DNA in tutto il genoma, suggerendo che i cambiamenti ereditari indotti dallo stress nei modelli di metilazione del DNA possono essere importanti nell'adattamento a stress ricorrenti. In un altro studio, le piante che sono state esposte a un moderato erbivoro di bruco per più generazioni hanno mostrato una maggiore resistenza all'erbivoro nelle generazioni successive (misurata dalla massa secca del bruco) rispetto alle piante prive di pressione da erbivoro. Questo aumento della resistenza degli erbivori è persistita dopo una generazione di crescita senza alcuna esposizione agli erbivori, il che suggerisce che la risposta è stata trasmessa attraverso le generazioni. Il rapporto ha concluso che i componenti della via di metilazione del DNA diretta dall'RNA sono coinvolti nell'aumento della resistenza attraverso le generazioni.
Negli umani
Sebbene l'ereditarietà genetica sia importante quando si descrivono gli esiti fenotipici , non può spiegare interamente perché la prole assomigli ai genitori. A parte i geni, la prole eredita condizioni ambientali simili stabilite dalle generazioni precedenti. Un ambiente che la prole umana condivide comunemente per nove mesi è l' utero . Considerando la durata delle fasi di sviluppo fetale , l'ambiente dell'utero materno può avere effetti di lunga durata sulla salute della prole. Un esempio di come l'ambiente all'interno dell'utero può influenzare la salute di una prole è l'inverno della fame olandese e il suo effetto causale sulle malattie ereditarie epigenetiche transgenerazionali indotte. Numerosi studi suggeriscono l'esistenza di un'eredità epigenetica transgenerazionale negli esseri umani, che include la carestia olandese del 1944-45 . Durante l'inverno della fame olandese, la prole nata durante la carestia era più piccola di quella nata l'anno prima della carestia. Gli effetti di questa carestia sullo sviluppo sono durati fino a due generazioni. Inoltre, è stato riscontrato che i figli nati durante la carestia hanno un aumentato rischio di intolleranza al glucosio nell'età adulta. La metilazione differenziale del DNA è stata trovata nella prole femminile adulta che era stata esposta alla carestia in utero, ma non è noto se queste differenze nella metilazione del DNA siano state trasmesse alla loro linea germinale. Si ipotizza che l'inibizione del gene PIM3 possa aver causato un metabolismo più lento nelle generazioni successive, ma la causalità non è stata dimostrata, solo una correlazione. Il fenomeno è a volte indicato come sindrome della fame invernale olandese . Inoltre, l'aumento dei tassi di malattie metaboliche , malattie cardiovascolari e altri fattori di rischio per la salute delle generazioni F1 e F2 durante l'inverno della fame olandese è un fenomeno noto chiamato " programmazione fetale ", che è causato dall'esposizione a fattori ambientali dannosi in utero. Un altro studio ha ipotizzato che i cambiamenti epigenetici sul cromosoma Y potrebbero spiegare le differenze nella durata della vita tra i discendenti maschi dei prigionieri di guerra nella guerra civile americana .
Lo studio Överkalix ha rilevato effetti specifici del sesso; un maggiore indice di massa corporea (BMI) a 9 anni nei figli, ma non nelle figlie, di padri che hanno iniziato a fumare presto. L'approvvigionamento alimentare del nonno paterno era legato solo alla mortalità RR dei nipoti e non delle nipoti. L'approvvigionamento alimentare della nonna paterna era associato solo al rapporto di rischio di mortalità delle nipoti. Quando la nonna aveva una buona scorta di cibo era associata a una mortalità doppia (RR). Questa eredità transgenerazionale è stata osservata con l'esposizione durante il periodo di crescita lenta (SGP). Il PSC è il tempo prima dell'inizio della pubertà , quando i fattori ambientali hanno un impatto maggiore sul corpo. Il PSC degli antenati in questo studio è stato fissato tra i 9-12 anni per i ragazzi e gli 8-10 anni per le ragazze. Ciò si è verificato nel PSC di entrambi i nonni, o durante il periodo di gestazione /vita infantile delle nonne, ma non durante la pubertà di entrambi i nonni. La scarsa disponibilità di cibo del padre e la buona disponibilità di cibo della madre erano associate a un minor rischio di morte cardiovascolare .
La perdita di espressione genetica che risulta nella sindrome di Prader-Willi o nella sindrome di Angelman è stata trovata in alcuni casi causata da cambiamenti epigenetici (o "epimutazioni") su entrambi gli alleli , piuttosto che coinvolgere qualsiasi mutazione genetica . In tutti i 19 casi informativi, le epimutazioni che, insieme all'imprinting fisiologico e quindi al silenziamento dell'altro allele , causavano queste sindromi, erano localizzate su un cromosoma di specifica origine parentale e nonno. In particolare, il cromosoma di origine paterna portava un segno materno anomalo presso lo SNURF-SNRPN e questo segno anomalo era ereditato dalla nonna paterna.
Allo stesso modo, sono state trovate epimutazioni sul gene MLH1 in due individui con un fenotipo di cancro colorettale ereditario non poliposico e senza alcuna mutazione MLH1 franca che altrimenti causa la malattia. Le stesse epimutazioni sono state riscontrate anche sugli spermatozoi di uno degli individui, indicando la possibilità di trasmettersi alla prole.
Oltre alle epimutazioni del gene MLH1 , è stato determinato che alcuni tumori, come il cancro al seno , possono originarsi durante le fasi fetali all'interno dell'utero . Inoltre, le prove raccolte in vari studi che utilizzano sistemi modello (ad es. animali) hanno scoperto che l'esposizione durante le generazioni dei genitori può provocare un'ereditarietà multigenerazionale e transgenerazionale del cancro al seno. Più di recente, gli studi hanno scoperto una connessione tra l'adattamento delle cellule germinali maschili attraverso le diete paterne preconcezionali e la regolazione del cancro al seno nella prole in via di sviluppo. Più specificamente, gli studi hanno iniziato a scoprire nuovi dati che sottolineano una relazione tra l'eredità epigenetica transgenerazionale del cancro al seno e componenti alimentari ancestrali o marcatori associati , come il peso alla nascita. Utilizzando sistemi modello, come i topi, gli studi hanno dimostrato che l'obesità paterna stimolata al momento del concepimento può alterare epigeneticamente la linea germinale paterna. La linea germinale paterna è responsabile della regolazione del peso delle loro figlie alla nascita e del potenziale per la loro figlia di sviluppare il cancro al seno. Inoltre, è stato scoperto che le modifiche al profilo di espressione dei miRNA della linea germinale maschile sono associate a un peso corporeo elevato. Inoltre, l'obesità paterna ha determinato un aumento della percentuale di figli femminili che sviluppano tumori mammari indotti da cancerogeni , che è causato da cambiamenti nell'espressione dei miRNA mammari.
A parte le afflizioni correlate al cancro associate agli effetti dell'ereditarietà epigenetica transgenerazionale, l'ereditarietà epigenetica transgenerazionale è stata recentemente implicata nella progressione dell'ipertensione arteriosa polmonare (PAH). Studi recenti hanno scoperto che è probabile che l'ereditarietà epigenetica transgenerazionale sia coinvolta nella progressione della PAH perché le attuali terapie per la PAH non riparano i fenotipi irregolari associati a questa malattia. Gli attuali trattamenti per la PAH hanno tentato di correggere i sintomi della PAH con vasodilatatori e protettori antitrombotici , ma nessuno dei due ha alleviato efficacemente le complicanze legate ai fenotipi alterati associati alla PAH. L'incapacità dei vasodilatatori e dei protettori antitrombotici di correggere la PAH suggerisce che la progressione della PAH dipenda da più variabili, il che è probabile che sia conseguente all'ereditarietà epigenetica transgenerazionale. Nello specifico, si pensa che l'epigenetica transgenerazionale sia legata ai cambiamenti fenotipici associati al rimodellamento vascolare . Ad esempio, l' ipossia durante la gestazione può indurre alterazioni epigenetiche transgenerazionali che potrebbero rivelarsi dannose durante le prime fasi dello sviluppo fetale e aumentare la possibilità di sviluppare la PAH in età adulta. Prendere in considerazione i potenziali effetti dell'epigenetica transgenerazionale durante lo sviluppo fetale deriva dall'ipotesi delle origini fetali della malattia dell'adulto (FOAD), che è collegata al concetto di programmazione fetale . Sebbene gli stati ipossici possano indurre la varianza epigenetica transgenerazionale associata alla PAH, vi sono prove evidenti a sostegno del fatto che una varietà di fattori di rischio materni siano collegati all'eventuale progressione della PAH. Tali fattori di rischio materno legati alla PAH a esordio tardivo includono disfunzione placentare, ipertensione, obesità e preeclampsia. Questi fattori di rischio materni e fattori di stress ambientale associati a cambiamenti epigenetici transgenerazionali possono provocare un insulto prolungato alle vie di segnalazione associate allo sviluppo vascolare durante le fasi fetali, aumentando così la probabilità di avere PAH.
Uno studio ha dimostrato che l'abuso infantile, definito come "contatto sessuale, grave abuso fisico e/o grave abbandono", porta a modificazioni epigenetiche dell'espressione del recettore dei glucocorticoidi. L'espressione del recettore dei glucocorticoidi svolge un ruolo vitale nell'attività ipotalamo-ipofisi-surrene (HPA). Inoltre, gli esperimenti sugli animali hanno dimostrato che i cambiamenti epigenetici possono dipendere dalle interazioni madre-bambino dopo la nascita. Inoltre, un recente studio che ha studiato le correlazioni tra lo stress materno in gravidanza e la metilazione negli adolescenti/le loro madri ha scoperto che i figli di donne che hanno subito abusi durante la gravidanza avevano maggiori probabilità di avere geni del recettore dei glucocorticoidi metilati. Pertanto, i bambini con geni del recettore dei glucocorticoidi metilati sperimentano una risposta alterata allo stress, che alla fine porta a una maggiore suscettibilità all'ansia.
Ulteriori studi che esaminano gli effetti del dietilstilbestrolo (DES), che è un interferente endocrino , hanno scoperto che i nipoti (terza generazione) delle donne esposte al DES hanno aumentato significativamente la probabilità che i loro nipoti sviluppino il disturbo da deficit di attenzione/iperattività (ADHD). Questo perché le donne esposte a interferenti endocrini , come il DES, durante la gestazione possono essere collegate a deficit multigenerazionali dello sviluppo neurologico . Inoltre, gli studi sugli animali indicano che gli interferenti endocrini hanno un profondo impatto sulle cellule germinali e sul neurosviluppo. Si ipotizza che la causa dell'impatto multigenerazionale del DES sia il risultato di processi biologici associati alla riprogrammazione epigenetica della linea germinale , anche se questo deve ancora essere determinato.
Effetti sulla forma fisica
L'ereditarietà epigenetica può influenzare l' idoneità solo se altera in modo prevedibile un tratto durante la selezione. Sono state fornite prove che gli stimoli ambientali sono agenti importanti nell'alterazione degli epigeni. Ironia della sorte, l'evoluzione darwiniana può agire su queste caratteristiche acquisite neo-lamarckiane così come sui meccanismi cellulari che le producono (es. geni della metiltransferasi). L'ereditarietà epigenetica può conferire un beneficio di idoneità agli organismi che affrontano i cambiamenti ambientali in tempi intermedi. È probabile che i cambiamenti a ciclo breve abbiano processi regolatori codificati dal DNA, poiché la probabilità che la prole debba rispondere ai cambiamenti più volte durante la loro vita è alta. Dall'altro lato, la selezione naturale agirà sulle popolazioni che subiranno cambiamenti a causa di cambiamenti ambientali a ciclo più lungo. In questi casi, se il priming epigenetico della generazione successiva è deleterio per l'idoneità per la maggior parte dell'intervallo (ad es. disinformazione sull'ambiente), questi genotipi ed epigenotipi andranno persi. Per cicli temporali intermedi, la probabilità che la prole incontri un ambiente simile è sufficientemente alta senza una sostanziale pressione selettiva su individui privi di un'architettura genetica in grado di rispondere all'ambiente. Naturalmente, le lunghezze assolute dei cicli ambientali brevi, intermedi e lunghi dipenderanno dal tratto, dalla lunghezza della memoria epigenetica e dal tempo di generazione dell'organismo. Gran parte dell'interpretazione degli effetti di fitness epigenetico è incentrata sull'ipotesi che gli epigeni siano importanti contributori ai fenotipi, che resta da risolvere.
Effetti deleteri
I segni epigenetici ereditati possono essere importanti per la regolazione di importanti componenti del fitness. Nelle piante, ad esempio, il gene Lcyc in Linaria vulgaris controlla la simmetria del fiore. Linneo descrisse per la prima volta mutanti radialmente simmetrici, che sorgono quando Lcyc è fortemente metilato. Data l'importanza della forma floreale per gli impollinatori, la metilazione degli omologhi Lcyc (es. CYCLOIDEA ) può avere effetti deleteri sull'idoneità della pianta. Negli animali, numerosi studi hanno dimostrato che i segni epigenetici ereditati possono aumentare la suscettibilità alle malattie. Si suggerisce anche che le influenze epigenetiche transgenerazionali contribuiscano alla malattia, in particolare al cancro, negli esseri umani. È stato dimostrato che i modelli di metilazione del tumore nei promotori del gene sono correlati positivamente con la storia familiare di cancro. Inoltre, la metilazione del gene MSH2 è correlata con i tumori del colon-retto e dell'endometrio a esordio precoce.
Effetti presumibilmente adattivi
I semi demetilati sperimentalmente dell'organismo modello Arabidopsis thaliana hanno mortalità significativamente più elevata, crescita stentata, fioritura ritardata e allegagione inferiore, indicando che gli epigeni possono aumentare la forma fisica. Inoltre, è stato dimostrato che le risposte epigenetiche allo stress indotte dall'ambiente sono ereditate e correlate positivamente con il fitness. Negli animali, la nidificazione in comune modifica il comportamento dei topi aumentando i regimi di cura dei genitori e le abilità sociali che si ipotizza possano aumentare la sopravvivenza della prole e l'accesso alle risorse (come cibo e compagni), rispettivamente.
Modelli macroevolutivi
Gli effetti epigenetici ereditati sui fenotipi sono stati ben documentati in batteri, protisti, funghi, piante, nematodi e moscerini della frutta. Sebbene non sia stato condotto alcuno studio sistematico sull'ereditarietà epigenetica (la maggior parte si concentra sugli organismi modello), vi sono prove preliminari che questa modalità di eredità è più importante nelle piante che negli animali. È probabile che la differenziazione precoce delle linee germinali animali precluda la marcatura epigenetica che si verifica più tardi nello sviluppo, mentre nelle piante e nei funghi le cellule somatiche possono essere incorporate nella linea germinale.
Si pensa che l'ereditarietà epigenetica transgenerazionale possa consentire a determinate popolazioni di adattarsi prontamente ad ambienti variabili. Sebbene ci siano casi ben documentati di eredità epigenetica transgenerazionale in alcune popolazioni, ci sono dubbi sul fatto che questa stessa forma di adattabilità sia applicabile ai mammiferi. Più specificamente, ci si chiede se si applica agli esseri umani. Di recente, la maggior parte dei modelli sperimentali che utilizzano topi e osservazioni limitate nell'uomo hanno trovato solo tratti ereditati epigeneticamente che sono dannosi per la salute di entrambi gli organismi. Questi tratti dannosi vanno dall'aumento del rischio di malattie, come le malattie cardiovascolari , alla morte prematura. Tuttavia, questo può essere basato sulla premessa di un bias di segnalazione limitato perché è più facile rilevare effetti sperimentali negativi, contrariamente a effetti sperimentali positivi. Inoltre, una considerevole riprogrammazione epigenetica necessaria per il successo evolutivo delle linee germinali e delle fasi iniziali dell'embriogenesi nei mammiferi può essere la potenziale causa che limita l'ereditarietà transgenerazionale dei segni della cromatina nei mammiferi.
I modelli di storia di vita possono anche contribuire al verificarsi dell'ereditarietà epigenetica. Gli organismi sessili , quelli con una bassa capacità di dispersione e quelli con un comportamento semplice possono trarre i maggiori benefici dal trasmettere informazioni alla loro prole attraverso percorsi epigenetici. Possono anche emergere modelli geografici, in cui ambienti altamente variabili e altamente conservati potrebbero ospitare meno specie con un'importante eredità epigenetica.
polemiche
Gli esseri umani hanno da tempo riconosciuto che i tratti dei genitori sono spesso visti nella prole. Questa intuizione ha portato all'applicazione pratica dell'allevamento selettivo di piante e animali, ma non ha affrontato la questione centrale dell'ereditarietà: come vengono conservati questi tratti tra le generazioni e cosa causa la variazione? Diverse posizioni sono state tenute nella storia del pensiero evoluzionista.
Eredità da miscelazione e particolato
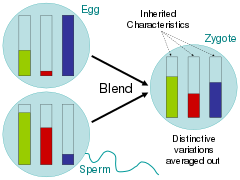
Rispondendo a queste domande correlate, gli scienziati durante il periodo dell'Illuminismo hanno ampiamente sostenuto l'ipotesi della fusione, in cui i tratti dei genitori erano omogeneizzati nella prole proprio come secchi di colori diversi mescolati insieme. I critici di On the Origin of Species di Charles Darwin , hanno sottolineato che sotto questo schema di ereditarietà, la variazione sarebbe stata rapidamente sommersa dal fenotipo maggioritario. Nell'analogia del secchio di vernice, questo sarebbe visto mescolando due colori insieme e quindi mescolando il colore risultante con solo uno dei colori genitori 20 volte; il raro colore della variante svanirebbe rapidamente.
Sconosciuto alla maggior parte della comunità scientifica europea, il monaco Gregor Mendel aveva risolto la questione di come si conservano i tratti tra le generazioni attraverso esperimenti di allevamento con piante di pisello. Charles Darwin quindi non era a conoscenza della proposta di "ereditarietà particellare" di Mendel in cui i tratti non erano mescolati ma trasmessi alla prole in unità discrete che ora chiamiamo geni. Darwin arrivò a rifiutare l'ipotesi della fusione anche se le sue idee e quelle di Mendel non furono unificate fino agli anni '30, un periodo indicato come la sintesi moderna .
Eredità di caratteristiche innate vs. acquisite
Nel suo libro del 1809, Philosophie Zoologique , Jean-Baptiste Lamarck riconobbe che ogni specie sperimenta una serie unica di sfide dovute alla sua forma e al suo ambiente. Pertanto, ha proposto che i caratteri usati più spesso accumulassero un "fluido nervoso". Tali accumuli acquisiti verrebbero quindi trasmessi alla prole dell'individuo. In termini moderni, un fluido nervoso trasmesso alla prole sarebbe una forma di eredità epigenetica.
Il lamarckismo , come divenne noto questo corpo di pensiero, era la spiegazione standard per il cambiamento delle specie nel tempo quando Charles Darwin e Alfred Russel Wallace proposero insieme una teoria dell'evoluzione per selezione naturale nel 1859. Rispondendo alla teoria di Darwin e Wallace, un neo -Il lamarckismo attirò un piccolo seguito di biologi, sebbene lo zelo lamarckiano fu in gran parte spento a causa del famoso esperimento di Weismann in cui tagliò la coda ai topi per diverse generazioni successive senza avere alcun effetto sulla lunghezza della coda. Così il consenso emergente che le caratteristiche acquisite non potevano essere ereditate divenne canonico.
Revisione della teoria evoluzionistica
La variazione e l'ereditarietà non genetiche, tuttavia, si sono rivelate abbastanza comuni. In concomitanza con lo sviluppo del XX secolo della moderna sintesi evolutiva (unificazione della genetica mendeliana e della selezione naturale), CH Waddington (1905-1975) stava lavorando per unificare la biologia dello sviluppo e la genetica. In tal modo, ha adottato la parola "epigenetica" per rappresentare la differenziazione ordinata delle cellule embrionali in tipi di cellule funzionalmente distinti nonostante abbiano una struttura primaria identica del loro DNA. I ricercatori hanno discusso sporadicamente dell'epigenetica di Waddington: è diventata più un toccasana per sconcertanti caratteri ereditabili non genetici piuttosto che un concetto che fa avanzare il corpo dell'indagine. Di conseguenza, la stessa definizione della parola di Waddington si è evoluta, ampliandosi oltre il sottoinsieme della specializzazione cellulare ereditata segnalata dallo sviluppo.
Alcuni scienziati si sono chiesti se l'ereditarietà epigenetica comprometta le fondamenta della sintesi moderna. Descrivendo il dogma centrale della biologia molecolare , Francis Crick ha affermato succintamente: "Il DNA è tenuto in una configurazione da istoni in modo che possa agire come un modello passivo per la sintesi simultanea di RNA e proteine. Nessuno dei dettagliati 'informazione' è nell'istone." Tuttavia, chiude l'articolo affermando: "questo schema spiega la maggior parte degli attuali risultati sperimentali!" In effetti, l'emergere dell'ereditarietà epigenetica (oltre ai progressi nello studio dello sviluppo evolutivo, della plasticità fenotipica , dell'evolvibilità e della biologia dei sistemi) ha messo a dura prova l'attuale struttura della moderna sintesi evolutiva e ha indotto il riesame di teorie evolutive precedentemente respinte. meccanismi.
Inoltre, i modelli di ereditarietà epigenetica e le implicazioni evolutive dei codici epigenetici in organismi viventi sono collegati sia Lamarck e di Darwin teorie dell'evoluzione. Ad esempio, Lamarck ha postulato che i fattori ambientali fossero responsabili della modifica ereditaria dei fenotipi , il che supporta i costrutti secondo cui l'esposizione a fattori ambientali durante le fasi critiche dello sviluppo può provocare epimutazioni nelle linee germinali , aumentando così la varianza fenotipica. Al contrario, la teoria di Darwin sosteneva che la selezione naturale rafforzasse la capacità delle popolazioni di sopravvivere e rimanere in forma riproduttiva favorendo popolazioni che sono in grado di adattarsi facilmente. Questa teoria è coerente con la plasticità intergenerazionale e la varianza fenotipica derivanti dall'adattabilità ereditaria.
Inoltre, una certa variabilità epigenetica può fornire una plasticità benefica , in modo che alcuni organismi possano adattarsi a condizioni ambientali fluttuanti. Tuttavia, lo scambio di informazioni epigenetiche tra generazioni può provocare aberrazioni epigenetiche, che sono tratti epigenetici che deviano dalla norma. Pertanto, la prole delle generazioni parentali può essere predisposta a malattie specifiche e ridotta plasticità a causa di aberrazioni epigenetiche. Sebbene la capacità di adattarsi prontamente di fronte a un nuovo ambiente possa essere vantaggiosa per alcune popolazioni di specie che possono riprodursi rapidamente, le specie con lunghi divari generazionali potrebbero non beneficiare di tale capacità. Se una specie con un divario generazionale più lungo non si adatta adeguatamente all'ambiente previsto, l' idoneità riproduttiva della prole di quella specie sarà ridotta.
C'è stata una discussione critica sulla teoria evolutiva tradizionale da Edward J Steele , Robyn A Lindley e colleghi, Fred Hoyle e N. Chandra Wickramasinghe , Yongsheng Liu Denis Noble , John Mattick e altri che le incongruenze logiche così come gli effetti dell'ereditarietà lamarckiana che coinvolgono il DNA diretto modifiche, così come l'indiretto appena descritto, vale a dire. epigenetica, le trasmissioni, sfidano il pensiero convenzionale nella biologia evoluzionistica e nei campi adiacenti.
Guarda anche
- Contributo delle modificazioni epigenetiche all'evoluzione
- Överkalix studio
- carestia olandese del 1944-1945 # Legacy
- Eredità dello stress transgenerazionale

