Classificazione del cancro al seno - Breast cancer classification
La classificazione del cancro al seno divide il cancro al seno in categorie in base a criteri di schemi diversi e con uno scopo diverso. Le categorie principali sono il tipo istopatologico , il grado del tumore, lo stadio del tumore e l'espressione di proteine e geni . Man mano che la conoscenza della biologia delle cellule tumorali si sviluppa, queste classificazioni vengono aggiornate.
Lo scopo della classificazione è selezionare il trattamento migliore. L'efficacia di un trattamento specifico è dimostrata per un cancro al seno specifico (di solito da studi randomizzati e controllati). Tale trattamento potrebbe non essere efficace in un altro cancro al seno. Alcuni tumori al seno sono aggressivi e pericolosi per la vita e devono essere trattati con trattamenti aggressivi che hanno importanti effetti avversi. Altri tumori al seno sono meno aggressivi e possono essere trattati con trattamenti meno aggressivi, come la lumpectomia.
Gli algoritmi di trattamento si basano sulla classificazione del cancro al seno per definire sottogruppi specifici che vengono trattati secondo le migliori evidenze disponibili . Gli aspetti di classificazione devono essere attentamente testati e convalidati, in modo tale che gli effetti confondenti siano ridotti al minimo, rendendoli o veri fattori prognostici , che stimano gli esiti della malattia come la sopravvivenza libera da malattia o in assenza di terapia , o veri fattori predittivi , che stimano la probabilità di risposta o mancata risposta a un trattamento specifico .
La classificazione del cancro al seno è solitamente, ma non sempre, basata principalmente sull'aspetto istologico del tessuto nel tumore. Una variante di questo approccio, definita sulla base dei risultati dell'esame fisico , è che il cancro al seno infiammatorio (IBC), una forma di carcinoma duttale o cancro maligno nei dotti, si distingue dagli altri carcinomi per l' aspetto infiammato della mammella colpita, che si correla con l'aumento dell'aggressività del cancro.
Schemi o aspetti
Panoramica
I tumori al seno possono essere classificati in base a diversi schemi. Ciascuno di questi aspetti influenza la risposta al trattamento e la prognosi. La descrizione di un cancro al seno includerebbe in modo ottimale tutti questi aspetti di classificazione, così come altri risultati, come i segni trovati all'esame obiettivo . Una classificazione completa include tipo istopatologico , grado , stadio (TNM) , stato del recettore e presenza o assenza di geni come determinato dal test del DNA :
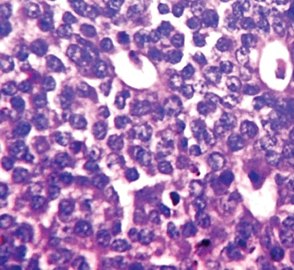
- Istopatologia . Sebbene il cancro al seno abbia molte istologie diverse , la maggior parte dei tumori al seno deriva dall'epitelio che riveste i dotti oi lobuli e viene classificata come carcinoma duttale mammario . Il carcinoma in situ è la proliferazione di cellule cancerose all'interno del tessuto epiteliale senza invasione del tessuto circostante. Al contrario, il carcinoma invasivo invade il tessuto circostante. L' invasione dello spazio perineurale e/o linfovascolare è generalmente considerata parte della descrizione istologica di un cancro al seno e, quando presente, può essere associata a una malattia più aggressiva.
- Grado . La classificazione si concentra sull'aspetto delle cellule del cancro al seno rispetto all'aspetto del normale tessuto mammario. Le cellule normali in un organo come il seno si differenziano, il che significa che assumono forme e forme specifiche che riflettono la loro funzione come parte di quell'organo. Le cellule cancerose perdono quella differenziazione. Nel cancro, le cellule che normalmente si allineerebbero in modo ordinato per formare i dotti lattiferi diventano disorganizzate. La divisione cellulare diventa incontrollata. I nuclei cellulari diventano meno uniformi. I patologi descrivono le cellule come ben differenziate (di basso grado), moderatamente differenziate (di grado intermedio) e scarsamente differenziate (di alto grado) poiché le cellule perdono progressivamente le caratteristiche osservate nelle normali cellule del seno. I tumori scarsamente differenziati hanno una prognosi peggiore.
-
Palcoscenico . La classificazione TNM per la stadiazione del cancro al seno si basa sulle dimensioni del cancro nel punto in cui è originariamente iniziato nel corpo e sui luoghi in cui è arrivato. Queste caratteristiche del cancro sono descritte come la dimensione del tumore (T), se il tumore si è diffuso o meno ai linfonodi (N) delle ascelle, del collo e all'interno del torace e se il tumore ha metastatizzato (M) ( cioè diffuso in una parte più distante del corpo). Dimensioni maggiori, diffusione linfonodale e metastasi hanno un numero di stadi maggiori e una prognosi peggiore. Le fasi principali sono:
- Stadio 0 che è la malattia in situ o la malattia di Paget del capezzolo . Lo stadio 0 è una condizione precancerosa o marker, carcinoma duttale in situ (DCIS) o carcinoma lobulare in situ (LCIS).
- Gli stadi 1-3 sono all'interno del seno o dei linfonodi regionali.
- Lo stadio 4 è un cancro metastatico . Il carcinoma mammario metastatico ha una prognosi meno favorevole.
- Stato del recettore . Le cellule hanno recettori sulla loro superficie, nel citoplasma e nel nucleo . I messaggeri chimici come gli ormoni si legano ai recettori e questo provoca cambiamenti nella cellula. Le cellule del cancro al seno possono avere o meno molti tipi diversi di recettori, i tre più importanti nella presente classificazione sono: recettore per gli estrogeni (ER), recettore per il progesterone (PR) e HER2/neu . Le cellule con o senza questi recettori sono chiamate ER positive (ER+), ER negative (ER-), PR positive (PR+), PR negative (PR-), HER2 positive (HER2+) e HER2 negative (HER2-). Le cellule prive di nessuno di questi recettori sono dette basali o triple negative .
- Classificazione basata sul DNA . Comprendere i dettagli specifici di un particolare cancro al seno può includere l'osservazione del DNA o dell'RNA delle cellule tumorali mediante diversi approcci di laboratorio. Quando nelle cellule tumorali vengono identificate specifiche mutazioni del DNA o profili di espressione genica, ciò può guidare la selezione dei trattamenti, mirando a questi cambiamenti o prevedendo da queste alterazioni quali terapie non mirate sono più efficaci.
-
Altri approcci di classificazione .
- Modelli di computer come Adjuvant! può combinare i vari aspetti della classificazione secondo algoritmi convalidati e presentare grafici visivamente accattivanti che aiutano nelle decisioni terapeutiche.
- L'indice prognostico USC/Van Nuys (VNPI) classifica il carcinoma duttale in situ (DCIS) in categorie di rischio dissimili che possono essere trattate di conseguenza.
- La scelta di quale trattamento ricevere può essere sostanzialmente influenzata dalle valutazioni di comorbilità .
- I tumori al seno familiari possono potenzialmente subire un trattamento dissimile (come la mastectomia ).
istopatologia

La classificazione istopatologica si basa sulle caratteristiche osservate al microscopio ottico dei campioni bioptici. Possono essere classificate a grandi linee in:
- Carcinoma in situ . Questo gruppo costituisce circa il 15-30% delle biopsie mammarie , soprattutto nei paesi con un'elevata copertura dei programmi di screening del seno . Questi hanno una prognosi favorevole, con tassi di sopravvivenza a 5 anni del 97-99%.
- Carcinoma invasivo . Questo gruppo costituisce l'altro 70-85%. Il tipo più comune in questo gruppo è il carcinoma duttale invasivo , che rappresenta circa l'80% dei carcinomi invasivi. Negli Stati Uniti, il 55% dei tumori al seno sono carcinomi duttali invasivi. Il carcinoma lobulare invasivo rappresenta circa il 10% dei carcinomi invasivi e il 5% di tutti i tumori al seno negli Stati Uniti. Il tasso di sopravvivenza globale a 5 anni sia per il carcinoma duttale invasivo che per il carcinoma lobulare invasivo era di circa l'85% nel 2003. Il carcinoma duttale in situ, d'altra parte, è di per sé innocuo, sebbene se non trattato circa il 60% di questi DCIS di basso grado le lesioni diventeranno invasive nel corso di 40 anni di follow-up.
Classificazione OMS
La classificazione 2012 dell'Organizzazione Mondiale della Sanità (OMS) dei tumori della mammella che include i tumori benigni (generalmente innocui) e i tumori maligni (cancerosi), raccomanda i seguenti tipi patologici:
|
Carcinomi mammari invasivi
Classico solido misto alveolare tubulolobulare pleomorfo
(Altri sottotipi ben accettati di carcinoma mammario metaplastico ritenuti significativi dal punto di vista clinico ma non inclusi nella classificazione WHO decennale:
Tumori mesenchimali (incluso il sarcoma )
|
Tumori del seno maschile
Linfoma maligno Tumori metastatici al seno da altre parti del corpo Lesioni precursori
Lesioni epiteliali benigne
Lesioni mioepiteliali
Tumori fibroepiteliali
Tumori benigni del capezzolo
Tumori maligni del capezzolo
|
Grado
La classificazione di un cancro al seno dipende dalla somiglianza microscopica delle cellule del cancro al seno con il tessuto mammario normale e classifica il cancro come differenziato (di basso grado), moderatamente differenziato (di grado intermedio) e scarsamente differenziato (di grado elevato). ), riflettendo cellule che appaiono progressivamente meno normali e che hanno una prognosi in peggioramento. Sebbene la classificazione sia fondamentalmente basata su come si comportano le cellule in coltura sottoposte a biopsia, in pratica la classificazione di un dato cancro è derivata dalla valutazione dell'aspetto cellulare del tumore. Più l'aspetto delle cellule cancerose è vicino alle cellule normali, più lenta è la loro crescita e migliore è la prognosi. Se le cellule non sono ben differenziate, appariranno immature, si divideranno più rapidamente e tenderanno a diffondersi. Al ben differenziato viene assegnato un grado di 1, moderato il grado 2, mentre a scarso o indifferenziato viene assegnato un grado superiore di 3 o 4 (a seconda della scala utilizzata).
Il sistema di Nottingham è raccomandato per la classificazione del cancro al seno. Il sistema di Nottingham è anche chiamato sistema Bloom-Richardson-Elston ( BRE ), o la modifica Elston-Ellis del sistema di classificazione Scarff-Bloom-Richardson. Classifica i carcinomi mammari sommando i punteggi per la formazione dei tubuli , il pleomorfismo nucleare e la conta mitotica , a ciascuno dei quali viene assegnato da 1 a 3 punti. I punteggi per ciascuno di questi tre criteri vengono poi sommati per dare un punteggio finale complessivo e il voto corrispondente . Non è applicabile ai carcinomi midollari che sono istologicamente di alto grado per definizione, mentre sono clinicamente di basso grado se i linfonodi sono negativi. Inoltre non è applicabile ai carcinomi metaplastici.
I criteri di valutazione sono i seguenti:
Formazione di tubuli
Questo parametro valuta quale percentuale del tumore forma le normali strutture del dotto. Nel cancro, c'è una rottura dei meccanismi che le cellule usano per attaccarsi tra loro e comunicare tra loro, per formare tessuti come i dotti, quindi le strutture tissutali diventano meno ordinate.
Nota: è necessario considerare l'aspetto generale del tumore.
- 1 punto: formazione di tubuli in più del 75% del tumore (può inoltre essere definito "maggioranza del tumore")
- 2 punti: formazione tubulare nel 10-75% del tumore ("moderato")
- 3 punti: formazione tubulare in meno del 10% del tumore ("poco o nessuno")
Pleomorfismo nucleare
Questo parametro valuta se i nuclei cellulari sono uniformi come quelli delle normali cellule epiteliali del dotto mammario, o se sono più grandi, più scuri o irregolari ( pleomorfi ). Nel cancro, i meccanismi che controllano i geni e i cromosomi nel nucleo si rompono e nuclei irregolari e cambiamenti pleomorfi sono segni di riproduzione cellulare anormale.
Nota: devono essere valutate le aree tumorali che presentano cellule con le maggiori anomalie cellulari .
- 1 punto: nuclei con variazione minima o lieve di dimensioni e forma
- 2 punti: nuclei con moderata variazione di dimensione e forma
- 3 punti: nuclei con marcata variazione di dimensione e forma
conteggio mitotico
Questo parametro valuta quante figure mitotiche (cellule in divisione) il patologo vede nel campo del microscopio ad alta potenza 10x. Una delle caratteristiche del cancro è che le cellule si dividono in modo incontrollabile. Più cellule si dividono, peggio è il cancro.
Nota: le figure mitotiche vengono contate solo alla periferia del tumore e il conteggio dovrebbe iniziare nelle aree più mitoticamente attive.
| Area per HPF | Punto | ||||
|---|---|---|---|---|---|
| 0,096 mm 2 | 0,12 mm 2 | 0,16 mm 2 | 0,27 mm 2 | 0,31 mm 2 | |
| 0-3 | 0-4 | 0-5 | 0-9 | 0-11 | 1 |
| 4-7 | 5-8 | 6-10 | 10-19 | 12-22 | 2 |
| >7 | >8 | >10 | >19 | >22 | 3 |
Voto complessivo
I punteggi per ciascuno di questi tre criteri vengono sommati per dare un punteggio complessivo finale e un voto corrispondente come segue:
- 3-5 Tumore di grado 1 ( ben differenziato ). Prognosi migliore .
- 6-7 Tumore di grado 2 ( moderatamente differenziato ). Prognosi media.
- 8-9 Tumore di grado 3 ( scarsamente differenziato ). Prognosi peggiore.
I tumori di grado inferiore, con una prognosi più favorevole, possono essere trattati in modo meno aggressivo e hanno un tasso di sopravvivenza migliore. I tumori di grado più elevato sono trattati in modo più aggressivo e il loro tasso di sopravvivenza intrinsecamente peggiore può giustificare gli effetti avversi di farmaci più aggressivi.
Palcoscenico
La stadiazione è il processo per determinare quanto cancro c'è nel corpo e dove si trova. Lo scopo alla base della stadiazione è descrivere l'estensione o la gravità del cancro di un individuo e riunire i tumori che hanno prognosi e trattamento simili . La stadiazione del cancro al seno è un aspetto della classificazione del cancro al seno che aiuta a fare scelte terapeutiche appropriate, se considerato insieme ad altri aspetti di classificazione come i livelli del recettore degli estrogeni e del recettore del progesterone nel tessuto tumorale, il recettore 2 del fattore di crescita epidermico umano ( HER2/neu ) lo stato, lo stato della menopausa e la salute generale della persona.
Le informazioni di stadiazione ottenute prima dell'intervento chirurgico, ad esempio mediante mammografia, raggi X e scansioni TC, sono chiamate stadiazione clinica e stadiazione chirurgica è nota come stadiazione patologica.
La stadiazione patologica è più accurata della stadiazione clinica, ma la stadiazione clinica è il primo e talvolta l'unico tipo di stadiazione. Ad esempio, se la stadiazione clinica rivela una malattia in stadio IV, un intervento chirurgico esteso potrebbe non essere utile e si otterranno (opportunamente) informazioni incomplete sulla stadiazione patologica.
L' American Joint Committee on Cancer (AJCC) e l' International Union Against Cancer (UICC) raccomandano la stadiazione TNM , che è una procedura in due fasi. Il loro sistema TNM, che ora lo sviluppo congiunto, il cancro prima classifica da diversi fattori, T per t umor, N per n odi, M per m etastasis, e poi gruppi di questi fattori TNM in tappe complessive.
Tumore primario (T)
T umor – I valori del tumore (TX, T0, Tis, T1, T2, T3 o T4) dipendono dal tumore nel sito primario di origine nel seno, come segue:
- TX: impossibilità di valutare quel sito
- Tis: carcinoma duttale in situ (DCIS), carcinoma lobulare in situ (LCIS) o morbo di Paget
- T1: Meno di 2 cm
- T1a: da 0,1 a 0,5 cm
- T1b: da 0,5 a 1,0 cm
- T1c: da 1,0 a 2,0 cm
- T2: da 2 a 5 cm
- T3: Più grande di 5 cm
- T4
- T4a: coinvolgimento della parete toracica
- T4b: coinvolgimento della pelle
- T4c: Sia 4a che 4b
- T4d: carcinoma mammario infiammatorio , una circostanza clinica in cui i cambiamenti tipici della pelle coinvolgono almeno un terzo del seno.
Linfonodi regionali (N)
Linfa N ODE - I linfonodi valori (NX, N0, N1, N2 o N3) dipendono dal numero, le dimensioni e la posizione dei depositi di cellule di cancro al seno in vari linfonodi regionali, come ad esempio l'ascella ( ascellare linfonodi ), il collare area ( linfonodi sopraclaveari ) e all'interno del torace (linfonodi mammari interni). L'ascella è designata come avente tre livelli: il livello I è l'ascella bassa, ed è al di sotto o all'esterno del bordo inferiore del muscolo piccolo pettorale ; il livello II è l'ascella media che è definita dai bordi del muscolo piccolo pettorale; e livello III, o ascella alta ( apicale ) che si trova sopra il muscolo piccolo pettorale. Ogni fase è la seguente:
- N0: ci sono alcune sfumature nelle definizioni ufficiali per la malattia N0, che include:
- N0(i+) : Cluster di cellule tumorali isolate (ITC), che sono piccoli cluster di cellule non superiori a 0,2 mm, o singole cellule tumorali, o un cluster di meno di 200 cellule in una singola sezione istologica, rilevata dalla routine istologia o immunoistochimica .
- N0(mol-): i linfonodi regionali non hanno metastasi istologicamente, ma hanno reperti molecolari positivi ( RT-PCR ).
- N1: Metastasi in 1-3 linfonodi ascellari e/o nei linfonodi mammari interni; e/o in linfonodi mammari interni clinicamente negativi con micrometastasi, o macrometastasi su biopsia del linfonodo sentinella.
- N1mi: Micrometastasi, cioè cluster linfonodali di almeno 2 mm o 200 cellule, ma meno di 2,0 mm. Almeno un focolaio di carcinoma superiore a 2,0 mm è chiamato "metastasi linfonodali". Se un nodo si qualifica come metastasi, anche tutti gli altri nodi, anche con focolai più piccoli, vengono contati come metastasi.
- N2: nodi ascellari ipsilaterali fissi/opachi.
- N3
- N3a – Nodi infraclavicolari omolaterali
- N3b – Nodi mammari interni omolaterali
- N3c – Nodi sopraclaveari omolaterali
Metastasi a distanza (M)
- M0: nessuna evidenza clinica o radiografica di metastasi a distanza
- M0(i+): cellule tumorali rilevate a livello molecolare o microscopico nel sangue circolante, nel midollo osseo o nel tessuto nodale non regionale, non più grandi di 0,2 mm, e senza evidenza clinica o radiografica o sintomi o segni di metastasi e che, forse controintuitivamente , non cambia il raggruppamento di stadi, poiché la stadiazione per in M0(i+) viene eseguita in base ai valori T e N
- M1: metastasi rilevabili a distanza come determinate dai classici mezzi clinici e radiografici e/o metastasi che sono istologicamente più grandi di 0,2 mm.
Fase generale
Una combinazione di T, N e M, come segue:
- Fase 0: Tis
- Fase I: T1N0
- Fase II: T2N0, T3N0 T0N1, T1N1 o T2N1
- Stadio III: invasione della pelle e/o delle costole, linfonodi arruffati, T3N1, T0N2, T1N2, T2N2, T3N2, AnyT N3, T4 qualsiasi N, carcinoma mammario localmente avanzato
- Stadio IV: M1, carcinoma mammario avanzato
| Stadio del cancro al seno (AJCC 5a edizione) |
Sopravvivenza globale a 5 anni di oltre 50.000 pazienti dal 1989 |
|---|---|
| Fase 0 | 92% |
| Fase I | 87% |
| Fase II | 75% |
| Fase III | 46% |
| Fase IV | 13% |
Stadiazione e prognosi
L'impatto delle diverse fasi sull'esito può essere apprezzato nella tabella seguente, pubblicata in un libro di testo del 2007, che mostra la sopravvivenza globale a 5 anni osservata di oltre 50.000 pazienti dal 1989 che sono stati riclassificati utilizzando i criteri della quinta edizione dell'AJCC; i dati sono disponibili anche nella fonte AJCC, che fornisce anche il tasso di sopravvivenza relativo rispetto a una popolazione di pari età (in realtà, età-sesso e razza). Questi dati sono storici, non mostrano l'influenza di importanti fattori aggiuntivi come il recettore per gli estrogeni (ER) o lo stato del recettore HER2/neu e non riflettono l'impatto dei nuovi trattamenti.
Edizioni precedenti
Sebbene la classificazione TNM sia un sistema concordato a livello internazionale, si è gradualmente evoluta attraverso le sue diverse edizioni; le date di pubblicazione e di adozione per l'uso delle edizioni AJCC sono riassunte nella tabella in questo articolo; le edizioni precedenti sono disponibili da AJCC per il download sul web.
Diversi fattori sono importanti quando si esaminano i rapporti per i singoli tumori al seno o quando si legge la letteratura medica e si applicano i dati di stadiazione.
| Edizione AJCC | pubblicato | è entrato in vigore | Link al cancro al seno e numeri di pagina nell'originale |
|---|---|---|---|
| 7 | 2009 | 2010 | AJCC o NCI |
| 6 | 2002 | 2003 | AJCC; pagine originali 223-240 |
| 5 | 1997 | 1998 | AJCC; pagine originali 171-180 |
| 4 | 1992 | 1993 | AJCC; pagine originali 149-154 |
| 3 | 1988 | 1989 | AJCC; pagine originali 145-150 |
| 2 | 1983 | 1984 | AJCC; pagine originali 127-134 |
| 1 | 1977 | 1978 | AJCC; pagine originali 101-108 |
È fondamentale essere consapevoli che i criteri del sistema TNM sono variati nel tempo, a volte in modo abbastanza sostanziale, a seconda delle diverse edizioni rilasciate da AJCC e UICC . I lettori sono assistiti dalla disposizione nella tabella di collegamenti diretti ai capitoli sul cancro al seno di queste varie edizioni.
Di conseguenza, un dato stadio può avere una prognosi piuttosto diversa a seconda dell'edizione di stadiazione utilizzata, indipendentemente da eventuali cambiamenti nei metodi o nei trattamenti diagnostici, un effetto che può contribuire alla "migrazione dello stadio" . Ad esempio, le differenze nelle categorie del 1998 e del 2003 hanno portato a molti tumori assegnati in modo diverso, con un apparente miglioramento dei tassi di sopravvivenza.
In pratica, i rapporti utilizzano spesso l'edizione temporanea che era in vigore all'inizio dello studio, piuttosto che la data di accettazione o pubblicazione. Tuttavia, vale la pena verificare se l'autore ha aggiornato il sistema di stadiazione durante lo studio o modificato le consuete regole di classificazione per l'uso specifico nell'indagine.
Un effetto diverso sulla stadiazione deriva dall'evoluzione delle tecnologie che vengono utilizzate per assegnare i pazienti a categorie particolari, in modo tale che metodi sempre più sensibili tendono a far sì che i singoli tumori vengano riassegnati a stadi più elevati, rendendo improprio confrontare la prognosi di quel cancro con le aspettative storiche per quel palcoscenico.
Infine, ovviamente, un'ulteriore considerazione importante è anche l'effetto del miglioramento dei trattamenti nel tempo.
Le edizioni precedenti presentavano tre valori metastatici (MX, M0 e M1) che si riferivano rispettivamente all'assenza di informazioni adeguate, all'assenza confermata o alla presenza di cellule di cancro al seno in sedi diverse dalla mammella e dai linfonodi regionali, come ossa, cervello , polmone.
L'AJCC ha fornito versioni poster accessibili sul web delle versioni correnti di questi descrittori e gruppi TNM protetti da copyright e i lettori devono fare riferimento a tali informazioni aggiornate e accurate o ai siti del National Cancer Institute (NCI) o del National Comprehensive Cancer Network che li ristampa con Autorizzazione AJCC.
Per dettagli accurati, completi e aggiornati fare riferimento alla documentazione protetta da copyright accessibile da AJCC o alla documentazione autorizzata da NCI o NCCN ; per le edizioni passate fare riferimento ad AJCC.
Stato del recettore
Lo stato del recettore dei tumori al seno è stato tradizionalmente identificato mediante immunoistochimica (IHC), che colora le cellule in base alla presenza di recettori per gli estrogeni (ER), recettori per il progesterone (PR) e HER2 . Questo rimane il metodo più comune per testare lo stato del recettore, ma i profili di espressione multigene del DNA possono classificare i tumori al seno in sottotipi molecolari che generalmente corrispondono allo stato del recettore IHC; una fonte commerciale è il test BluePrint, come discusso nella sezione seguente .
Lo stato del recettore è una valutazione critica per tutti i tumori al seno in quanto determina l'idoneità all'uso di trattamenti mirati come il tamoxifene e/o il trastuzumab . Questi trattamenti sono ora alcuni dei trattamenti adiuvanti più efficaci del cancro al seno. Recettore estrogeno positivo (ER +) cellule tumorali dipendono estrogeni per la loro crescita, in modo che possano essere trattati con farmaci per ridurre sia gli effetti degli estrogeni (per esempio tamoxifen ) o il livello effettivo di estrogeni (es aromatase inibitori ), e generalmente hanno una migliore prognosi . Generalmente, prima dei trattamenti moderni, HER+ aveva una prognosi peggiore, tuttavia le cellule tumorali HER2+ rispondono a farmaci come l'anticorpo monoclonale, trastuzumab , (in combinazione con la chemioterapia convenzionale) e questo ha migliorato significativamente la prognosi. Al contrario, il cancro triplo negativo (cioè nessun recettore positivo), privo di trattamenti mirati, ha ora una prognosi relativamente sfavorevole .
Il recettore degli androgeni è espresso nell'80-90% dei tumori al seno ER+ e nel 40% dei tumori al seno "triplo negativi". L'attivazione dei recettori degli androgeni sembra sopprimere la crescita del cancro al seno nel cancro ER+ mentre nel cancro ER- sembra agire come promotore della crescita. Sono in corso sforzi per utilizzare questo come marker prognostico e trattamento.
Sottotipo molecolare
Lo stato del recettore è stato tradizionalmente considerato esaminando a turno ogni singolo recettore (ER, PR, her2), ma gli approcci più recenti considerano questi insieme, insieme al grado del tumore , per classificare il cancro al seno in diverse classi molecolari concettuali che hanno prognosi diverse e possono avere risposte diverse a terapie specifiche. I microarray del DNA hanno aiutato questo approccio, come discusso nella sezione seguente . I sottotipi molecolari proposti includono:
- Simil basale: ER-, PR- e HER2-; chiamato anche carcinoma mammario triplo negativo (TNBC). La maggior parte dei tumori al seno BRCA1 sono TNBC basali.
- Luminale A: ER+ e basso grado
- Luminale B: ER+ ma spesso di alto grado
- Luminal ER-/AR+: (sovrapposizione con apocrino e cosiddetto apocrino molecolare) - sottotipo reattivo agli androgeni recentemente identificato che può rispondere al trattamento antiormonale con bicalutamide
- ERBB2/HER2-amplificato: ha sovraespresso HER2/neu
- Normale simile al seno
- Claudin -low: una classe descritta più recentemente; spesso triplo negativo, ma distinto dal fatto che vi è una bassa espressione delle proteine di giunzione cellula-cellula inclusa la caderina E e frequentemente c'è un'infiltrazione con linfociti .
| Luminale A | Luminale B | ERBB2/HER2 amplificato | di tipo basale | |
|---|---|---|---|---|
| Espressione genica complessiva | Alta espressione di:
|
Rispetto al Luminale A, maggiore espressione di:
Espressione inferiore di:
|
|
Alta espressione di:
Bassa espressione di:
|
| Tipi di microscopia ottica |
|
|
|
|
| Immunoistochimica |
|
|
|
|
| mutazioni genetiche |
|
Simile al luminale A ma:
|
|
|
Classificazione del DNA
Classificazione tradizionale del DNA
Tradizionale DNA classificazione si è basata sull'osservazione generale che le cellule che sono dividono più rapidamente hanno una peggiore prognosi , e si basava su entrambi la presenza di proteine Ki67 o la percentuale di DNA di cellule di cancro in fase S . Questi metodi e i sistemi di punteggio che utilizzavano la ploidia del DNA , sono usati molto meno spesso ora, poiché il loro potere predittivo e prognostico era meno sostanziale di altri schemi di classificazione come lo stadio TNM . Al contrario, le moderne analisi del DNA sono sempre più rilevanti nel definire la biologia del cancro sottostante e nell'aiutare a scegliere i trattamenti.
HER2/neu
Lo stato di HER2/neu può essere analizzato mediante saggi di ibridazione in situ fluorescente (FISH). Alcuni commentatori preferiscono questo approccio, affermando una correlazione più elevata rispetto all'immunoistochimica del recettore con la risposta al trastuzumab , una terapia mirata, ma le linee guida consentono entrambi i metodi di test.
Microarray di DNA
Sfondo
I microarray di DNA hanno confrontato le cellule normali con le cellule del cancro al seno e hanno trovato differenze nell'espressione di centinaia di geni . Sebbene il significato di molte di queste differenze genetiche sia sconosciuto, analisi indipendenti di diversi gruppi di ricerca hanno scoperto che alcuni gruppi di geni hanno la tendenza a coesprimersi. Questi cluster co-esprimenti hanno incluso geni correlati al recettore ormonale , geni correlati a HER2 , un gruppo di geni simili alla base e geni di proliferazione . Come potrebbe quindi essere previsto, esiste una notevole somiglianza tra le classificazioni del recettore e dei microarray, ma l'assegnazione dei singoli tumori non è affatto identica. A titolo illustrativo, alcune analisi hanno suggerito che circa il 75% dei recettori classificato tumori al seno triplo negativo (TNBC) basale-come tumori hanno il profilo di espressione del DNA previsto e un analogo 75% dei tumori con una tipica basale simile espressione DNA profilo sono anche i recettori TNBC. Per dirlo in modo diverso per enfatizzare le cose, ciò significa che il 25% dei tumori basali del cancro al seno triplo negativo (TNBC) come definiti dall'una o dall'altra classificazione sono esclusi dai risultati della classificazione alternativa. È in fase di studio quale schema di classificazione (recettore IHC o profilo di espressione del DNA ) associ in modo più affidabile particolari tumori a terapie efficaci.
Diversi test di DNA microarray commercializzati analizzano gruppi di geni e possono aiutare a decidere quale possibile trattamento è più efficace per un particolare cancro . L'uso di questi test nei tumori al seno è supportato da prove di livello II o di livello III . Nessun test sono stati verificati da Livello I prove , che è rigorosamente definito come derivati da un prospettico , randomizzato e controllato in cui i pazienti che hanno utilizzato il test ha avuto un risultato migliore rispetto a quelli che non hanno. L'acquisizione di ampie prove di livello I sarebbe clinicamente ed eticamente impegnativa. Tuttavia, vengono attivamente perseguiti diversi approcci di convalida.
Sono stati sviluppati numerosi profili genetici. I più commercializzati sono:
- Oncotype DX è supportato da prove di livello II ed è stato originariamente progettato per l'uso in tumori positivi al recettore degli estrogeni (ER) ed è stato approvato dall'American Society of Clinical Oncology (ASCO) e dal NCCN .
- MammaPrint è supportato solo da prove di livello III , può essere eseguito su tumori positivi e negativi del recettore degli estrogeni (ER) e ha l' approvazione della FDA .
- Anche altri due test hanno solo prove di livello III : Theros e MapQuant Dx.
Questi test multigeni, alcuni parzialmente e altri completamente commercializzati, sono stati rivisti scientificamente per confrontarli con altri metodi standard di classificazione del cancro al seno come il grado e lo stato dei recettori . Sebbene questi profili di espressione genica guardino a diversi geni individuali , sembrano classificare un dato tumore in gruppi di rischio simili e quindi fornire previsioni concordanti di esito.
Sebbene ci siano prove considerevoli che questi test possono affinare le decisioni terapeutiche in una percentuale significativa di tumori al seno, sono piuttosto costosi; i criteri di selezione proposti per i quali particolari tumori possono trarre beneficio dall'essere interrogati da questi test rimangono controversi , in particolare con i tumori linfonodali positivi. Una revisione ha caratterizzato questi test genetici collettivamente come l'aggiunta di " informazioni prognostiche modeste per i pazienti con tumori HER2- positivi e triplo-negativi, ma quando le misure del rischio clinico sono equivoche (p. es., espressione intermedia di ER e grado istologico intermedio), questi test potrebbero guidare decisioni cliniche”.
Oncotipo DX
Oncotype DX valuta 16 geni correlati al cancro e 5 geni di riferimento normali di confronto, ed è quindi talvolta noto come dosaggio dei 21 geni. È stato progettato per l'uso nei tumori positivi al recettore degli estrogeni (ER) . Il test viene eseguito su in formalina , tessuto fissato in paraffina. I risultati dell'oncotipo sono riportati come Recurrence Score (RS), dove un RS più elevato è associato a una prognosi peggiore , riferendosi alla probabilità di recidiva senza trattamento. Oltre a quel ruolo prognostico , un RS più elevato è anche associato a una maggiore probabilità di risposta alla chemioterapia , che è definita un fattore predittivo positivo .
Questi risultati suggeriscono che non solo Oncotype stratifica il carcinoma mammario positivo per il recettore degli estrogeni in diversi gruppi prognostici , ma suggerisce anche che i tumori che hanno un risultato di microarray Oncotype DX particolarmente favorevole tendono a trarre un beneficio minimo dalla chemioterapia adiuvante e quindi potrebbe essere appropriato scegliere per evitare effetti collaterali da quel trattamento aggiuntivo. Come ulteriore esempio, un programma di trattamento clinico neoadiuvante che includeva una chemioterapia iniziale seguita da un intervento chirurgico e successiva chemioterapia aggiuntiva, radioterapia e terapia ormonale ha riscontrato una forte correlazione della classificazione dell'oncotipo con la probabilità di una risposta completa (CR) alla chemioterapia prechirurgica.
Poiché le caratteristiche ad alto rischio possono già essere evidenti in molti tumori ad alto rischio, ad esempio la negatività del recettore ormonale o la malattia HER-2 positiva, il test Oncotype può migliorare in particolare la valutazione del rischio che deriva dalle variabili cliniche di routine nella malattia a rischio intermedio. I risultati sia negli Stati Uniti che a livello internazionale suggeriscono che Oncotype può aiutare nelle decisioni terapeutiche.
Oncotype DX è stato approvato dall'American Society of Clinical Oncology (ASCO) e dal NCCN . Il gruppo del NCCN considera il test del 21 gene come un'opzione nella valutazione di alcuni tumori per aiutare a stimare la probabilità di recidiva e beneficiare della chemioterapia , sottolineando che il punteggio di recidiva dovrebbe essere usato insieme ad altri elementi di classificazione del cancro al seno quando si stratifica il rischio . Oncotype ha soddisfatto tutti i criteri del California Technology Assessment Forum (CTAF) nell'ottobre 2006. La Food and Drug Administration (FDA) statunitense non impone l'approvazione di questa classe di test se vengono eseguiti in un unico laboratorio gestito dall'azienda Genomic Health, che ha sviluppato Oncotype DX, offre il test in base a queste cosiddette regole della birra fatta in casa e, di conseguenza, in tale misura il test Oncotype DX non è specificamente approvato dalla FDA.
MammaPrint e BluePrint
Il pattern genico MammaPrint è un pannello di 70 geni in stadio commerciale commercializzato da Agedia, sviluppato in pazienti di età inferiore a 55 anni con carcinoma mammario linfonodale negativo (N0) . Il test commerciale è commercializzato per l'uso nel cancro al seno indipendentemente dallo stato del recettore per gli estrogeni (ER). Il test viene eseguito su tessuto fissato in formalina e incluso in paraffina. MammaPrint utilizzava tradizionalmente tessuto congelato rapidamente, ma un fissativo molecolare a temperatura ambiente è disponibile per l'uso entro 60 minuti dall'ottenimento di campioni di tessuto fresco. MammaPrint classifica i tumori come ad alto o basso rischio .
Un riepilogo degli studi clinici che utilizzano MammaPrint è incluso nell'articolo principale di MammaPrint . Le prove disponibili per Mammaprint sono state riviste dal California Technology Assessment Forum (CTAF) nel giugno 2010; il rapporto scritto indicava che MammaPrint non aveva ancora soddisfatto tutti i criteri CTAF. MammaPrint ha 5 autorizzazioni FDA ed è l'unico test per microarray approvato dalla FDA disponibile. Per essere idoneo per il profilo di espressione genica MammaPrint , un carcinoma mammario deve avere le seguenti caratteristiche: stadio 1 o 2, dimensione del tumore inferiore a 5,0 cm, recettore per gli estrogeni positivo (ER+) o recettore per gli estrogeni negativo (ER-). Negli Stati Uniti, il tumore dovrebbe anche essere linfonodi negativi (N0) , ma a livello internazionale il test può essere eseguito se lo stato dei linfonodi è negativo o positivo con un massimo di 3 linfonodi.
Un metodo per valutare il sottotipo molecolare di un cancro al seno è quello di BluePrint, un pannello di 80 geni in fase commerciale commercializzato da Agendia, sia come test autonomo, sia combinato con il profilo del gene MammaPrint .
Altri test del DNA e scelta del trattamento
La scelta dei farmaci chemioterapici consolidati, se è necessaria la chemioterapia, può anche essere influenzata dai test del DNA che predicono la resistenza o la sensibilità relativa. L'espressione della topoisomerasi II (TOP2A) predice se la doxorubicina è relativamente utile. L'espressione dei geni che regolano la tubulina può aiutare a prevedere l'attività dei taxani .
Vari bersagli del percorso molecolare e risultati del DNA vengono incorporati nella progettazione di sperimentazioni cliniche di nuovi farmaci. Geni specifici come p53, NME1, BRCA e PIK3CA/Akt possono essere associati alla reattività delle cellule tumorali a prodotti farmaceutici di ricerca innovativi. Le varianti polimorfiche BRCA1 e BRCA2 possono aumentare il rischio di cancro al seno e questi tumori tendono ad esprimere una serie di geni, come p53, in un modello che è stato chiamato "BRCA-ness". I tumori derivanti da mutazioni BRCA1 e BRCA2, così come altri tumori che condividono un simile profilo di "BRCA-ness", inclusi alcuni tumori al seno triplo negativi del recettore basale, possono rispondere al trattamento con inibitori di PARP come olaparib . La combinazione di questi farmaci più recenti con agenti più vecchi come la 6-tioguanina (6TG) può superare la resistenza che può insorgere nei tumori BRCA agli inibitori di PARP o alla chemioterapia a base di platino. Gli inibitori di mTOR come everolimus possono mostrare più effetto nei mutanti PIK3CA/Akt e9 che nei mutanti e20 o nei wild type.
I modelli di metilazione del DNA possono influenzare epigeneticamente l'espressione genica nel cancro al seno e possono contribuire ad alcune delle differenze osservate tra i sottotipi genetici.
Tumori che sovraesprimono il Wnt segnalazione pathway co-recettore a bassa densità lipoproteina recettore proteina correlata 6 (LRP6) possono rappresentare un sottotipo distinto di cancro al seno e un potenziale bersaglio trattamento.
Numerose indagini cliniche hanno esaminato se il test per alleli polimorfici del genotipo variante di diversi geni potesse prevedere se prescrivere o meno il tamoxifene ; questo si basava su possibili differenze nel tasso di conversione del tamoxifene nel metabolita attivo, endoxifene. Sebbene alcuni studi avessero suggerito un potenziale vantaggio dal test del CYP2D6 , i dati di due ampi studi clinici non hanno riscontrato alcun beneficio. I test per il polimorfismo CYP2C19*2 hanno dato risultati controintuitivi. L'utilità medica dei potenziali biomarcatori della reattività del tamoxifene come HOXB13 , PAX2 e l' interazione delle isoforme alfa e beta del recettore degli estrogeni (ER) con SRC3 devono ancora essere completamente definiti.
Altri approcci di classificazione
Modelli di computer
I modelli informatici considerano diversi fattori tradizionali contemporaneamente per derivare previsioni di sopravvivenza individuali e calcoli dei potenziali benefici del trattamento. Gli algoritmi convalidati possono presentare grafici visivamente accattivanti che aiutano nelle decisioni terapeutiche. Inoltre, esistono altre classificazioni dei tumori al seno e nessun sistema uniforme è stato adottato in modo coerente in tutto il mondo.
coadiuvante! si basa su coorti statunitensi e presenta grafici a barre colorati che mostrano informazioni che possono aiutare nelle decisioni relative alle terapie adiuvanti sistemiche . La validazione di successo è stata osservata con coorti canadesi e olandesi. coadiuvante! sembrava meno applicabile a una coorte britannica e di conseguenza PREDICT è in fase di sviluppo nel Regno Unito.
Altri test immunoistochimici
Tra i molti test immunoistochimici che possono ulteriormente stratificare la prognosi , BCL2 ha mostrato risultati promettenti negli studi preliminari.
Indice prognostico di Van Nuys
L'indice prognostico USC/Van Nuys (VNPI) classifica il carcinoma duttale in situ (DCIS) in categorie di rischio dissimili che possono essere trattate di conseguenza.
Valutazioni di comorbilità
La scelta di quale trattamento ricevere può essere sostanzialmente influenzata dalle valutazioni di comorbilità .
Tumori al seno familiari
Ci sono alcune prove che i tumori al seno che insorgono in gruppi familiari , come la sindrome ereditaria del cancro della mammella-ovaio , possono avere una prognosi dissimile. Anche un trattamento potenzialmente dissimile.